Phản ứng giữa Sắt(III) Oxit (Fe₂O₃) và Axit Nitric (HNO₃) là một phản ứng axit – bazơ đặc trưng, thể hiện tính chất của oxit bazơ. Fe₂O₃ tác dụng với HNO₃ tạo ra muối Sắt(III) Nitrat (Fe(NO₃)₃) và nước (H₂O). Phản ứng giúp ta hiểu cách oxit kim loại phản ứng với axit mạnh, và có ứng dụng trong phân tích hóa học cũng như xử lý quặng sắt.

Phương Trình Hóa Học
Phương trình chưa cân bằng:
\[F{e_2}{O_3} + HN{O_3}_{(loãng)} \to Fe{(N{O_3})_3} + {H_2}O\]
Phương trình đã cân bằng:
\[F{e_2}{O_3} + 6HN{O_3}_{(loãng)} \to 2Fe{(N{O_3})_3} + 3{H_2}O\]
Trạng thái chất:
\[F{e_2}{O_3}_{(r)} + HN{O_3}_{(dd)} \to Fe{(N{O_3})_3}_{(dd)} + 3{H_2}{O_{(l)}}\]
Điều Kiện Phản Ứng
Nhiệt độ: Phản ứng xảy ra ở nhiệt độ thường hoặc gia nhiệt nhẹ (50-80°C) để tăng tốc độ hòa tan.
Nguyên Lý Phản Ứng
Đây là phản ứng axit – bazơ:
Cơ chế:
HNO₃ phân ly hoàn toàn tạo ion H+:
\[HN{O_3} \to {H^ + } + N{O_3}^ – \]
Fe₂O₃ (oxit bazơ, chứa Fe³⁺) phản ứng với H⁺ từ HNO₃, phá vỡ liên kết Fe-O.
\[F{e_2}{O_3} + 6{H^ + } \to 2F{e^{3 + }} + 3{H_2}O\]
Fe³⁺ kết hợp với NO₃⁻ thành Fe(NO₃)₃.
Cách Thực Hiện Phản Ứng
Chuẩn bị:
- Sắt(III) oxit (Fe₂O₃) dạng bột mịn hoặc hematit tinh chế.
- Dung dịch HNO₃ loãng, nếu dùng HNO₃ đặc sẽ có tính nhớt làm giảm khả năng phản ứng.
- Dụng cụ: Ống nghiệm, bình phản ứng, đèn cồn hoặc bếp điện (nếu gia nhiệt), pipet, đũa thủy tinh.
- Thiết bị hỗ trợ: Tủ hút để xử lý hơi HNO₃, kính bảo hộ, găng tay chống axit.
Trình tự tiến hành:
- Cho một lượng Fe₂O₃ (khoảng 1-2 g) vào ống nghiệm hoặc bình phản ứng.
- Thêm từ từ HNO₃ (khoảng 5-10 ml), khuấy đều bằng đũa thủy tinh.
- Quan sát phản ứng: Nếu phản ứng chậm, gia nhiệt nhẹ (50-80°C) bằng đèn cồn hoặc bếp điện.
- Quan sát hiện tượng: Fe₂O₃ (màu đỏ gạch) tan dần, tạo dung dịch màu vàng/nâu nhạt (do Fe³⁺).
- Sau khi Fe₂O₃ tan hoàn toàn, làm nguội dung dịch, kiểm tra sản phẩm Fe(NO₃)₃ bằng thuốc thử.
Lưu ý:
- HNO₃ có tính ăn mòn và oxi hóa mạnh, cần thao tác cẩn thận, tránh tiếp xúc da hoặc mắt.
- Fe₂O₃ dạng bột mịn dễ gây bụi, cần xử lý trong môi trường thông thoáng.
- Nếu muốn thu Fe(NO₃)₃ dạng rắn, cô cạn dung dịch (trong điều kiện kiểm soát, tránh phân hủy).
Nhận Biết Phản Ứng
Hiện tượng quan sát được:
Chất rắn Fe₂O₃ (màu đỏ gạch) tan dần trong HNO₃, tạo dung dịch màu vàng/nâu nhạt (do ion Fe³⁺).
Kiểm chứng sản phẩm:
Fe(NO₃)₃ (dung dịch chứa Fe³⁺):
Cách 1: Thêm NaOH hoặc NH₃: Phản ứng tạo kết tủa đỏ nâu (Fe(OH)₃), xác nhận có Fe³⁺.
Cách 2: Thêm vài giọt KSCN (kali thiocyanat) vào dung dịch: Dung dịch xuất hiện màu đỏ máu (do phức [Fe(SCN)]²⁺), chứng tỏ có Fe³⁺.
Phản ứng liên quan
Tác dụng với H₂SO₄:
\[F{e_2}{O_3} + {H_2}S{O_4} \to F{e_2}{(S{O_4})_3} + 3{H_2}O\]
Tác dụng với HCl:
\[F{e_2}{O_3} + 6HCl \to 2FeC{l_3} + 3{H_2}O\]
Phản ứng khử Fe₂O₃:
\[F{e_2}{O_3} + 3C \to 2Fe + 3CO\] (lò cao, 1000-1500°C).
Phản ứng nhận biết Fe³⁺:
\[Fe{(N{O_3})_3} + 3KSCN \to Fe{(SCN)_3}\downarrow + 3KN{O_3}\] (màu đỏ máu).
Hoặc kết tủa Fe³⁺: \[Fe{(N{O_3})_3} + 3NaOH \to Fe{(OH)_3} \downarrow + 3NaN{O_3}\]
Sản phẩm nhiệt phân của muối nitrat phụ thuộc vào kim loại
Khi nung nóng các muối nitrat, sản phẩm thu được không giống nhau, mà thay đổi theo bản chất của kim loại tạo muối. Cụ thể:
- Muối nitrat của kim loại kiềm (như Na, K, Li):
\[2NaN{O_3} \mathop \to \limits^{\Delta} 2NaN{O_2} + O_2 \uparrow\]
→ Tạo muối nitrit tương ứng và khí oxi.
- Muối nitrat của kim loại kiềm thổ (như Ca, Mg, Ba), và một số kim loại chuyển tiếp hóa trị thấp (từ Mg²⁺ đến Fe³⁺ trong bảng điện hóa kim loại):
\[2Ca{(N{O_3})_2} \mathop \to \limits^{\Delta} 2CaO + 4N{O_2} \uparrow + O_2 \uparrow\]
\[2Fe{(N{O_3})_3} \mathop \to \limits^{\Delta} {Fe_2}{O_3} + 6N{O_2} \uparrow + 3/2O_2 \uparrow\]
→ Tạo oxit kim loại, khí NO₂ và O₂.
- Muối nitrat của các kim loại dễ bị khử (như Ag⁺, Hg²⁺):
\[2AgN{O_3} \mathop \to \limits^{\Delta} 2Ag + 2N{O_2} \uparrow + O_2 \uparrow\]
→ Tạo oxit kim loại bền (hoặc kim loại nếu ion bị khử được), cùng với khí NO₂ và O₂.
Nguyên nhân dẫn đến sự khác biệt về sản phẩm nhiệt phân
Sự khác biệt trong sản phẩm nhiệt phân bắt nguồn từ đặc điểm điện tử và khả năng oxi hóa–khử của ion kim loại. Có ba yếu tố chính:
Độ bền nhiệt của gốc NO₃⁻ phụ thuộc vào mức độ phân cực
- Gốc NO₃⁻ có cấu trúc cộng hưởng và khá bền về mặt điện tử.
- Tuy nhiên, khi gắn với cation kim loại, trường điện tích của cation sẽ phân cực đám mây electron của NO₃⁻, làm yếu liên kết N–O và thúc đẩy phân hủy.
- Cation có bán kính nhỏ – điện tích lớn (như Fe³⁺, Al³⁺) gây phân cực mạnh hơn cation có điện tích thấp (như Na⁺, K⁺), khiến NO₃⁻ dễ bị phân hủy sâu hơn.
Tính khử của cation kim loại
- Nếu cation kim loại dễ bị khử (như Ag⁺ → Ag⁰), khi nhiệt phân nó sẽ bị khử luôn, sản phẩm rắn là kim loại.
- Nếu cation có mức oxi hóa cao nhưng ổn định (như Fe³⁺, Cu²⁺), sản phẩm thường là oxit tương ứng (Fe₂O₃, CuO).
Độ bền của oxit tạo thành
- Trong nhiều trường hợp, sự hình thành oxit bền về mặt nhiệt động thúc đẩy phản ứng xảy ra hoàn toàn.
- Oxit kim loại như Fe₂O₃ hay CaO có enthalpy hình thành âm lớn → là sản phẩm bền và được ưu tiên hình thành khi có đủ điều kiện nhiệt độ.
Cơ chế nhiệt phân của muối sắt(III) nitrat – vai trò của Fe³⁺
Fe(NO₃)₃ là một muối của kim loại chuyển tiếp có hóa trị cao (Fe³⁺), mang nhiều đặc điểm đáng chú ý trong cơ chế nhiệt phân:
Cấu trúc và liên kết trong ion NO₃⁻
Ion nitrat NO₃⁻ có cấu trúc cộng hưởng, với 3 liên kết N–O tương đương, mang đặc trưng π giữa nguyên tử nitơ trung tâm (hybrid sp²) và 3 nguyên tử oxy.
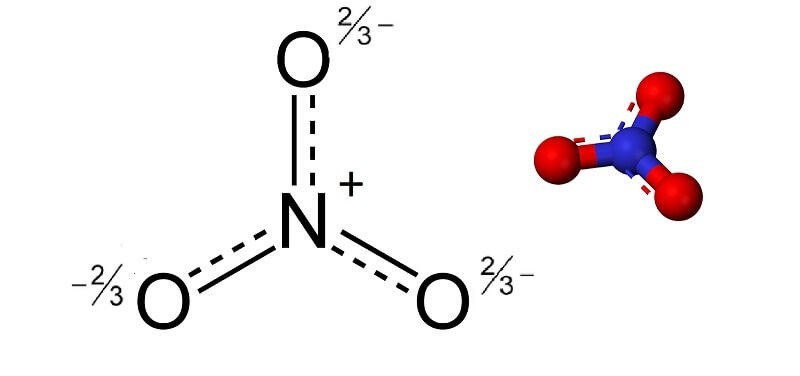
Các liên kết N–O đều có tính bán đôi (không hoàn toàn đơn, cũng không hoàn toàn đôi, do có sự delocalization – sự di chuyển phi cục bộ đến các vị trí nhất định của cặp electron liên kết π).
Vì vậy, liên kết N–O nội phân tử khá bền trong điều kiện thường, và ion NO₃⁻ ổn định với điện tích âm phân bố đều trên 3 nguyên tử oxy.
Fe³⁺ là cation có khả năng phân cực rất mạnh
Fe³⁺ có bán kính ion nhỏ (khoảng 64 pm) và điện tích +3, tạo ra một trường điện tích rất mạnh.
- Nó hút cặp electron từ các phân tử hoặc ion có cặp electron không liên kết (các phối tử như NO₃⁻, H₂O, OH⁻,…).
- Khi phối hợp với NO₃⁻, Fe³⁺ tạo phức ion, thường qua nguyên tử O của NO₃⁻.
Trong trường này gốc NO₃⁻ phân cực mạnh, Fe³⁺ sẽ hút cặp electron không liên kết từ nguyên tử oxy của NO₃⁻. Sự tương tác này tạo ra một liên kết phối trí tạm thời, qua đó làm giảm mật độ electron giữa nitơ và oxy trong nhóm NO₃⁻, khiến liên kết π (pi) trong hệ cộng hưởng bị suy yếu.
Nói cách khác, Fe³⁺ đã phá vỡ cấu trúc cộng hưởng bền vững của NO₃⁻, vốn là cấu trúc làm cho ba liên kết N–O trong NO₃⁻ gần như tương đương. Khi liên kết cộng hưởng này bị phá vỡ cục bộ do lực hút từ ion Fe³⁺, một trong các liên kết N–O trở nên yếu hơn các liên kết còn lại và trở thành vị trí dễ bị gãy khi cung cấp thêm năng lượng dưới dạng nhiệt.
Khi liên kết N–O trở nên yếu hơn, phân tử NO₃⁻ dễ bị phân cắt thành các phân tử khí:
\[2N{O_3}^ – \to 2NO_2 \uparrow + O_2 \uparrow\]
→ Cơ chế này là một dạng nội phân tử oxi hóa – khử (disproportionation): nitơ trong NO₃⁻ vừa bị khử (tạo NO₂), vừa bị oxy hóa (tạo O₂).
Hình thành oxit sắt(III) bền:
- Khi nhiệt độ đủ cao, các ion Fe³⁺ sẽ kết hợp với oxy từ gốc nitrat để tạo thành oxit Fe₂O₃.
- Đây là oxit bền nhiệt và có cấu hình điện tử thuận lợi: Fe³⁺ có cấu hình 3d⁵ bán bền, ổn định trong môi trường oxi hóa.
Tổng thể phản ứng:
\[2Fe{(N{O_3})_3} \mathop \to \limits^{\Delta} {Fe_2}{O_3} + 6N{O_2} \uparrow + 3/2O_2 \uparrow\]
→ Phản ứng xảy ra mạnh do:
- Gốc NO₃⁻ bị phân cực bởi Fe³⁺ nên dễ phân hủy.
- Sản phẩm khí (NO₂, O₂) dễ thoát khỏi hệ → kéo cân bằng về phía sản phẩm.
- Fe₂O₃ là chất rắn bền → phản ứng thuận lợi về mặt nhiệt động.
Ứng Dụng
- Phòng thí nghiệm: Chuẩn bị dung dịch Fe³⁺ để phân tích hóa học (nhận biết ion, thí nghiệm định tính).
- Công nghiệp: Hòa tan Fe₂O₃ trong quặng để tách sắt, phục vụ luyện kim.
- Xử lý môi trường: Fe(NO₃)₃ dùng trong xử lý nước thải, keo tụ chất lơ lửng.
Bài Tập Vận Dụng
Đề bài: Cho 8 g Fe₂O₃ phản ứng hoàn toàn với HNO₃ theo phương trình:\[F{e_2}{O_3} + 6HN{O_3}_{(loãng)} \to Fe{(N{O_3})_3} + 3{H_2}O\]. Tính:
a) Thể tích dung dịch HNO₃ 2M cần dùng (lít).
b) Khối lượng Fe(NO₃)₃ thu được (g).
Giải:
Phương trình: \[F{e_2}{O_3} + 6HN{O_3}_{(loãng)} \to Fe{(N{O_3})_3} + 3{H_2}O\]
a) Thể tích HNO₃ 2M:
Số mol Fe₂O₃:
\[{n_{F{e_2}{O_3}}} = \frac{8}{{160}} = 0,05mol\].
Tỉ lệ mol Fe₂O₃:HNO₃ = 1:6, nên:
\[{n_{HN{O_3}}} = 0,05 \times 6 = 0,3mol\]
Thể tích HNO₃:
\[{V_{HN{O_3}}} = \frac{n}{{{C_M}}} = \frac{{0,3}}{2} = 0,15L\]
Đáp số: Thể tích HNO₃ cần dùng là 0,15 L (150 mL).
b) Khối lượng Fe(NO₃)₃:
Tỉ lệ mol Fe₂O₃:Fe(NO₃)₃ = 1:2, nên:
\[{n_{Fe{{(N{O_3})}_3}}} = 0,05 \times 2 = 0,1mol\].
Khối lượng phân tử Fe(NO₃)₃:
\[{M_{Fe{{(N{O_3})}_3}}} = 56 + (14 + 16 \times 3) \times 3 = 242{\rm{ }}gram/mol\].
Khối lượng Fe(NO₃)₃:
\[{m_{Fe{{(N{O_3})}_3}}} = 0,1 \times 242 = 24,2{\rm{ }}gram\].
Đáp số: Khối lượng Fe(NO₃)₃ thu được là 24,2 g.
