Phản ứng phân hủy nhiệt của sắt(II) cacbonat trong môi trường có oxi là một phản ứng điển hình trong quá trình xử lý quặng sắt siderit để tạo ra oxit sắt(III) – một tiền chất quan trọng trong luyện kim và tổng hợp vật liệu.
Phản ứng này là sự kết hợp giữa quá trình phân hủy muối cacbonat và sự oxi hóa sắt(II) lên sắt(III) bởi oxi trong không khí. Đây là một phản ứng nhiệt phân có kèm oxi hóa.

Phương trình hóa học
\[FeCO_3 + O_2 \xrightarrow{\Delta} Fe_2O_3 + CO_2 \uparrow\]
Phương trình phản ứng đã cân bằng:
\[4FeCO_3 + O_2 \xrightarrow{\Delta} 2Fe_2O_3 + 4CO_2 \uparrow\]
Điều kiện phản ứng
- Nhiệt độ cao: khoảng từ 400 đến 600°C.
- Môi trường có oxi (không khí hoặc khí oxi tinh khiết).
- Phản ứng cần được thực hiện trong hệ thống mở để khí CO₂ thoát ra ngoài.
Điều kiện nhiệt là yếu tố then chốt để phá vỡ liên kết giữa các ion trong mạng tinh thể của muối FeCO₃, đồng thời cung cấp năng lượng cho quá trình oxi hóa Fe²⁺ thành Fe³⁺.
Nguyên lý phản ứng
Phản ứng xảy ra qua hai giai đoạn liên tiếp:
- Giai đoạn phân hủy muối cacbonat:
\[FeCO_3 \xrightarrow{\Delta} FeO + CO_2\]
- Giai đoạn oxi hóa FeO:
\[4FeO + O_2 \to 2Fe_2O_3\]
Tổng hợp lại:
\[4FeCO_3 + O_2 \xrightarrow{\Delta} 2Fe_2O_3 + 4CO_2\]
Phản ứng đầu là sự phân hủy, phản ứng sau là quá trình oxi hóa.
Phân tích quá trình oxi hóa – khử
- Fe trong FeCO₃ có số oxi hóa +2.
- Sau phản ứng, Fe trong Fe₂O₃ có số oxi hóa +3.
- Như vậy, Fe²⁺ → Fe³⁺ là quá trình oxi hóa.
- Oxi phân tử (O₂) là chất oxi hóa, nhận electron để tạo ion O²⁻.
- CO₃²⁻ bị phân hủy, giải phóng CO₂ mà không tham gia trực tiếp vào quá trình khử hay oxi hóa.
Cân bằng electron (bán phản ứng):
\[Fe^{2+} \to Fe^{3+} + e\]
\[\frac{1}{2}O_2 + 2e^- \to O^{2-}\]
Gộp lại cho 4 nguyên tử Fe:
\[4Fe^{2+} + O_2 \rightarrow 4Fe^{3+} + 2O^{2-}\]
Các ion O²⁻ sẽ tham gia vào mạng tinh thể của Fe₂O₃.
Cách tiến hành phản ứng trong phòng thí nghiệm
Chuẩn bị:
Hóa chất:
- Bột FeCO₃ tinh khiết hoặc quặng siderit được tinh chế.
Dụng cụ:
- Chén sứ chịu nhiệt.
- Đèn cồn hoặc lò nung điện.
- Kẹp sắt, giá đỡ.
- Ống dẫn khí và bình chứa nước vôi trong (Ca(OH)₂) để nhận biết khí CO₂.
- Quạt hút khí hoặc buồng phản ứng có thông gió tốt.
Tiến hành:
- Cho khoảng 2–3 gam bột FeCO₃ vào chén sứ.
- Đặt chén vào lò nung (nếu có) hoặc đun bằng đèn Bunsen với ngọn lửa xanh mạnh, tập trung vào đáy chén.
- Dẫn khí sinh ra qua ống dẫn khí nối với bình nước vôi trong để kiểm tra sự tạo thành CO₂.
- Quan sát hiện tượng: chất rắn đổi màu, khí sinh ra làm đục nước vôi.
- Sau khoảng 15 phút đun liên tục, dừng nung, để nguội và thu lấy chất rắn còn lại để kiểm tra sản phẩm.
Lưu ý:
- Sử dụng oxi tinh khiết nếu muốn phản ứng oxi hóa xảy ra triệt để.
- Nhiệt độ phải đạt trên 400°C, nếu không chỉ xảy ra phân hủy FeCO₃ mà không đủ năng lượng cho quá trình oxi hóa FeO.
- Đảm bảo thông khí tốt, CO₂ tích tụ có thể làm chậm quá trình oxi hóa FeO.
Nhận biết phản ứng và kiểm tra sản phẩm
Dấu hiệu phản ứng đang xảy ra:
- Có khí thoát ra khỏi hỗn hợp rắn đang nung.
- Khí này làm đục nước vôi trong: chứng minh là CO₂.
- Màu của chất rắn chuyển từ xám lục (FeCO₃) → xám đen (FeO) → đỏ nâu (Fe₂O₃).
Kiểm tra sự hình thành Fe₂O₃:
Phản ứng định tính:
- Lấy một phần sản phẩm sau nung, cho vào dung dịch HCl dư:
\[Fe_2O_3 + 6HCl \to 2FeCl_3 + 3H_2O\]
Dung dịch thu được có màu vàng nâu nhạt đặc trưng của ion Fe³⁺.
Phản ứng với KSCN (thuốc thử đặc trưng):
\[Fe^{3+} + 3SCN^- \rightarrow [Fe(SCN)_3] \text{ (màu đỏ máu)}\]
Nếu xuất hiện màu đỏ máu, chứng tỏ đã có Fe³⁺ → phản ứng đã hoàn tất đến Fe₂O₃.
Chi tiết các giai đoạn phản ứng giữa Sắt(II) Cacbonat và Oxi ở cấp độ phân tử
Cấu trúc ban đầu của FeCO₃ (sắt(II) cacbonat)
FeCO₃ tồn tại ở trạng thái rắn dưới dạng một mạng tinh thể ion, trong đó các ion Fe²⁺ và CO₃²⁻ được liên kết với nhau bằng lực hút tĩnh điện.
Cation Fe²⁺ là một ion kim loại có cấu hình electron [Ar] 3d⁶, thường được bao quanh bởi sáu phối tử trong trạng thái bát diện, đóng vai trò như tâm phối trí trong tinh thể. Anion CO₃²⁻ có cấu trúc hình phẳng tam giác, gồm một nguyên tử cacbon trung tâm liên kết với ba nguyên tử oxy, trong đó các liên kết C–O có tính cộng hưởng rất rõ rệt. Cấu trúc cộng hưởng này giúp phân bố đều mật độ điện tích âm trên các nguyên tử oxy, làm cho ba liên kết C–O gần như tương đương nhau về chiều dài và năng lượng liên kết.
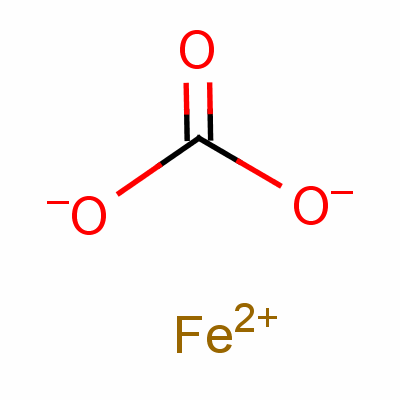
Dưới điều kiện thường, mạng tinh thể của FeCO₃ khá bền vững. Tuy nhiên, bản thân các liên kết C–O trong CO₃²⁻, mặc dù có tính cộng hưởng, vẫn là những điểm yếu tiềm tàng nếu phân tử phải chịu tác động của một lượng nhiệt lớn. Liên kết giữa cacbon và oxy trong nhóm cacbonat là liên kết kém bền hơn so với liên kết ion giữa Fe²⁺ và CO₃²⁻, do đó đây sẽ là điểm khởi đầu cho quá trình phân hủy nhiệt.
Giai đoạn 1: Hấp thụ năng lượng và kích hoạt dao động mạng tinh thể
Khi FeCO₃ được nung nóng đến nhiệt độ khoảng 300–400°C, các ion trong mạng tinh thể bắt đầu hấp thụ nhiệt năng. Nhiệt độ tăng làm gia tăng biên độ dao động của các ion Fe²⁺ và CO₃²⁻ quanh vị trí cân bằng trong mạng. Ở mức năng lượng đủ lớn, dao động này trở nên mạnh đến mức làm suy yếu sự bền vững của liên kết C–O trong nhóm cacbonat, đặc biệt là liên kết nối cacbon với oxy mang điện tích âm hơn.
Đây là mốc năng lượng tại đó năng lượng liên kết C–O yếu nhất bị vượt qua, thường vào khoảng 414 – 532 kJ/mol. Khi đó, hệ thống bắt đầu xảy ra quá trình phân cắt liên kết một cách cục bộ, mở đường cho phản ứng phân hủy ion CO₃²⁻.
Giai đoạn 2: Phân cắt liên kết và phân hủy ion CO₃²⁻
Quá trình phân hủy không diễn ra ngay lập tức, mà bắt đầu từ sự phân cực trong phân bố mật độ electron của anion CO₃²⁻. Một trong ba liên kết C–O bị đẩy electron mạnh hơn, dẫn đến sự phân rã cấu trúc cộng hưởng. Khi mật độ electron dồn về phía một nguyên tử oxy, liên kết với nguyên tử này trở nên yếu nhất và bị bẻ gãy. Kết quả là một nguyên tử oxy tách ra dưới dạng ion oxide O²⁻, trong khi hai nguyên tử còn lại tái tổ chức cùng nguyên tử cacbon để tạo thành phân tử CO₂ trung hòa. Phương trình phản ứng có thể viết dưới dạng:
\[CO_3^{2-} \xrightarrow{\Delta} CO_2 \uparrow + O^{2-}\]
Ngay sau khi ion O²⁻ hình thành, nó không tồn tại độc lập mà lập tức bị hút bởi ion Fe²⁺ gần kề trong mạng tinh thể. Hai ion trái dấu này kết hợp để tạo ra oxit sắt(II), FeO, dưới dạng rắn. Sự tạo thành FeO tại chỗ khiến cấu trúc mạng tinh thể FeCO₃ bị phá vỡ cục bộ, chuẩn bị cho các quá trình tái tổ chức sau đó.
Giai đoạn 3: Giải phóng CO₂ và thúc đẩy phản ứng thuận
Phân tử CO₂ vừa được hình thành là một phân tử trung tính, có cấu trúc tuyến tính, không tích điện và không có vùng tương tác mạnh với mạng ion. Vì thế, ngay sau khi được sinh ra, nó nhanh chóng thoát khỏi pha rắn do có bán kính khuếch tán lớn và ít bị giữ lại bởi bất kỳ liên kết nào trong mạng tinh thể.
Việc CO₂ thoát ra khỏi hệ thống phản ứng giúp giảm áp suất khí nội mạng và kéo cân bằng phản ứng theo hướng tạo sản phẩm, theo nguyên lý Le Châtelier. Đồng thời, sự thoát khí CO₂ còn làm mạng tinh thể ban đầu trở nên mất ổn định tại những điểm phân hủy, tạo ra khoảng trống cần thiết cho sự hình thành mạng tinh thể FeO kế tiếp.
Giai đoạn 4: Tái cấu trúc tinh thể và hình thành FeO
Sau khi ion Fe²⁺ đã gắn với O²⁻, mạng tinh thể mới của FeO bắt đầu hình thành. Quá trình này không xảy ra ngay lập tức mà cần thời gian để các ion sắp xếp lại vào những vị trí năng lượng tối ưu. Các ion Fe²⁺ và O²⁻ kết hợp để tạo thành mạng tinh thể lập phương tâm diện, kiểu NaCl, trong đó hai loại ion này xen kẽ nhau một cách tuần hoàn. Tuy nhiên, FeO không hoàn toàn bền vững về mặt hóa học. Trong thực tế, nó luôn tồn tại ở dạng phiếm định với công thức gần đúng là Fe₁₋ₓO. Điều này là do mạng tinh thể thường thiếu hụt một phần nhỏ ion Fe²⁺ để giữ sự cân bằng điện tích nội mạng.
Sự thiếu hụt ion Fe²⁺ không phải là khuyết điểm đơn thuần mà chính là đặc tính quan trọng về mặt phản ứng. Những vị trí trống trong mạng này tạo ra các khoảng không gian cho các nguyên tử khí bên ngoài, đặc biệt là O₂, có thể thâm nhập vào và phản ứng. Như vậy, mạng tinh thể FeO tuy mới được hình thành nhưng đã tiềm tàng khả năng tiếp tục biến đổi khi có sự hiện diện của oxy và năng lượng nhiệt.
Giai đoạn 5: Xâm nhập của O₂ và quá trình oxy hóa FeO thành Fe₂O₃
Khi nhiệt độ tiếp tục được duy trì hoặc tăng cao, các phân tử O₂ trong khí quyển bắt đầu thâm nhập vào mạng tinh thể FeO thông qua các khe khuếch tán hoặc vị trí trống do khuyết tật mạng tạo ra.
Trong điều kiện nhiệt độ cao, các phân tử O₂ có thể hấp thụ năng lượng và bị phân ly thành hai nguyên tử oxy tự do (O•), là những gốc tự do rất hoạt hóa về mặt hóa học. Các nguyên tử này dễ dàng khuếch tán vào sâu trong mạng tinh thể và có xu hướng tìm kiếm electron để ổn định điện tích, vì mỗi nguyên tử oxy ở trạng thái tự do đều thiếu hai electron so với cấu hình bền.
\[O_2 \to 2O \cdot\]
Khi nguyên tử O• tiếp xúc với ion Fe²⁺ trong mạng, nó sẽ nhận electron từ Fe²⁺ và chuyển thành ion O²⁻. Quá trình này đồng thời làm ion Fe²⁺ mất electron và chuyển thành Fe³⁺.
\[O \cdot + 2Fe^{2+} \to Fe^{3+} + O^{2-}\]
Phản ứng oxy hóa – khử này diễn ra ở nhiều điểm trong mạng, tạo ra sự chuyển tiếp dần dần từ oxit sắt(II) sang oxit sắt(III). Việc biến đổi Fe²⁺ thành Fe³⁺ làm thay đổi bán kính ion – từ 0.78 Å xuống còn 0.645 Å – và điện tích, khiến cấu trúc mạng bị căng thẳng và không còn phù hợp với mô hình tinh thể cũ. Để giải tỏa áp lực nội mạng, các ion sẽ sắp xếp lại vào vị trí tối ưu hơn về năng lượng, tạo thành một mạng tinh thể mới.
Giai đoạn 6: Tái tổ chức mạng và hình thành Fe₂O₃ (hematit)
Khi quá trình oxy hóa tiếp tục lan rộng, mạng FeO ban đầu được thay thế bởi mạng Fe₂O₃. Trong điều kiện nhiệt độ cao và dư oxy, dạng cấu trúc Fe₂O₃ ổn định nhất là hematit (α-Fe₂O₃). Đây là một mạng tinh thể thuộc hệ lục phương hình thoi (rhombohedral), trong đó các ion Fe³⁺ chiếm các vị trí bát diện, liên kết với các ion O²⁻ xung quanh theo cả mặt và cạnh. Sự sắp xếp này tạo nên một mạng tinh thể cực kỳ ổn định, có độ bền nhiệt cao và mang tính chất từ đặc trưng của hematit. Với cấu trúc này, phản ứng đã đi đến giai đoạn cuối cùng – hình thành sản phẩm oxy hóa bền vững nhất từ sắt(II) cacbonat ban đầu.

Các tính chất đặc biệt của Fe₂O₃
Ngoài các tính chất thông thường như màu đỏ nâu, không tan trong nước và có tính lưỡng tính yếu, Fe₂O₃ còn thể hiện một số tính chất đặc biệt đáng chú ý trong hóa học vật liệu và phản ứng học:
Tính đa hình (polymorphism)
Fe₂O₃ tồn tại ở nhiều dạng cấu trúc tinh thể (đa hình), bao gồm α-Fe₂O₃, β-Fe₂O₃ và γ-Fe₂O₃. Mỗi dạng mang đặc điểm về tính chất vật lý và hóa học riêng biệt, liên quan đến cách sắp xếp ion Fe³⁺ và O²⁻ trong mạng tinh thể. Tính đa hình này tạo nên sự khác biệt lớn về:
- Độ ổn định nhiệt
- Đặc tính từ (magnetic properties)
- Hoạt tính bề mặt
- Tính dẫn điện và dẫn ion
Tính chất từ đặc biệt
- α-Fe₂O₃ là chất phản sắt từ (antiferromagnetic) ở nhiệt độ thường, chuyển sang dạng sắt từ yếu (weak ferromagnetic) ở trên 260°C (nhiệt độ Morin).
- β-Fe₂O₃ có tính từ dị thường do cấu trúc không đối xứng, thường thể hiện sắt từ nhẹ hoặc hành vi từ hỗn hợp.
- γ-Fe₂O₃ có cấu trúc gần giống spinel, thể hiện tính sắt từ mạnh (ferromagnetism) ngay ở nhiệt độ phòng.
Tính xúc tác dị thể
Fe₂O₃ có khả năng làm chất xúc tác trong các phản ứng oxy hóa-khử ở pha khí, đặc biệt là γ-Fe₂O₃ và β-Fe₂O₃ nhờ diện tích bề mặt riêng cao và mạng lưới ion không bão hòa. Điều này được ứng dụng trong:
- Xúc tác xử lý khí thải
- Cảm biến khí
- Phản ứng Fenton dị thể trong xử lý nước
Khả năng tham gia phản ứng phụ thuộc vào cấu trúc
Dạng α-Fe₂O₃ rất bền và phản ứng chậm, trong khi γ-Fe₂O₃ và β-Fe₂O₃ có hoạt tính hóa học cao hơn do cấu trúc mạng chứa nhiều khuyết tật hoặc phối trí ion không hoàn chỉnh, dễ tham gia vào phản ứng acid, phản ứng khử hoặc phản ứng hấp phụ.
Các dạng mạng lưới tinh thể của Fe₂O₃ và sự ảnh hưởng đến tính chất
α-Fe₂O₃ (Hematit)
- Cấu trúc: Dạng lục phương (hexagonal) kiểu corundum, với các ion Fe³⁺ nằm trong vị trí bát diện được chia sẻ cạnh với ion O²⁻.
- Độ bền: Ổn định nhất về mặt nhiệt động học, tồn tại phổ biến trong tự nhiên.
- Tạo thành: Dạng này có trong các quặng Hematit tự nhiên, hoặc hình thành khi nung Fe(OH)₃ ở nhiệt độ cao (>600°C) trong không khí.
- Ảnh hưởng lên phản ứng:
- Hoạt tính hóa học thấp nhất trong các dạng Fe₂O₃.
- Tính phản ứng tăng nếu vật liệu có kích thước nano hoặc bị pha tạp.
γ-Fe₂O₃ (Maghemit)
- Cấu trúc: Spinel biến thể thiếu (defective spinel), các ion Fe³⁺ phân bố trong các lỗ trống bát diện và tứ diện, với một phần lỗ trống không được lấp đầy tạo ra các khuyết tật mạng (vacancies).
- Độ bền: Kém bền hơn α-Fe₂O₃, dễ chuyển hóa thành dạng α nếu gia nhiệt (>300–400°C).
- Tạo thành: Thường thu được khi nung Fe₃O₄ trong không khí ở điều kiện nhiệt độ trung bình.
- Ảnh hưởng lên phản ứng:
- Hoạt tính hóa học và bề mặt cao hơn do khuyết tật mạng.
- Thường dùng trong xúc tác dị thể, cảm biến từ và vật liệu từ mềm.
β-Fe₂O₃ (Beta-Fe₂O₃)
- Cấu trúc: Trực thoi (orthorhombic), mạng ion Fe³⁺ phân bố bất đối xứng trong các vị trí bát diện và tứ diện, gây ra độ méo mạnh trong mạng.
- Độ bền: Rất kém bền, chỉ ổn định trong một khoảng nhiệt độ hẹp (~500–600°C), dễ chuyển sang dạng α hoặc γ.
- Tạo thành: Yêu cầu điều kiện tổng hợp đặc biệt như phản ứng thủy nhiệt hoặc phân hủy hợp chất trung gian.
- Ảnh hưởng lên phản ứng:
- Có hoạt tính hóa học rất cao.
- Ứng dụng trong vật liệu xúc tác tiên tiến, vật liệu dẫn ion, thiết bị lưu trữ năng lượng.

So sánh tổng quát các dạng tinh thể Fe₂O₃
| Tính chất | α-Fe₂O₃ | γ-Fe₂O₃ | β-Fe₂O₃ |
| Cấu trúc | Corundum (hexagonal) | Spinel biến thể | Orthorhombic |
| Độ bền nhiệt | Cao nhất | Trung bình | Thấp (metastable) |
| Hoạt tính hóa học | Thấp | Trung bình | Cao |
| Khả năng dẫn điện | Kém | Tốt hơn | Tốt (hướng nghiên cứu) |
| Tính chất từ | Antiferromagnetic | Ferromagnetic | Weak ferromagnetic |
| Điều kiện hình thành | >600°C, không khí | 300–400°C, oxy hóa | 500–600°C, đặc biệt |
Vì sao phản ứng tỏa nhiệt nhưng cần phải gia nhiệt để gia tăng hiệu suất
Phân biệt giữa nhiệt động học và động học phản ứng
Phản ứng giữa FeCO₃ và O₂ là phản ứng tỏa nhiệt, tức có ΔH < 0, cho thấy phản ứng có chiều thuận về mặt năng lượng. Điều này nghĩa là sản phẩm Fe₂O₃ có năng lượng tự do Gibbs thấp hơn so với tổng năng lượng của FeCO₃ và O₂, nên phản ứng xảy ra là thuận lợi về nhiệt động học.
Tuy nhiên, việc một phản ứng có tính tự phát về mặt nhiệt động không có nghĩa là nó sẽ xảy ra nhanh chóng hoặc đáng kể trong điều kiện thường. Tốc độ phản ứng lại do yếu tố động học chi phối, cụ thể là năng lượng hoạt hóa Ea.
Rào cản năng lượng hoạt hóa
Để phản ứng xảy ra, hệ phải vượt qua một rào cản năng lượng gọi là năng lượng hoạt hóa. Trong trường hợp phản ứng FeCO₃ + O₂, năng lượng hoạt hóa gồm các thành phần:
- Năng lượng cần để nhiệt phân FeCO₃ thành FeO và CO₂
- Năng lượng cần để phân tách phân tử O₂ thành O nguyên tử.
- Năng lượng cần để ion Fe²⁺ bị oxy hóa thành Fe³⁺.
- Năng lượng cần để phá vỡ cấu trúc cũ và tái hình thành mạng tinh thể mới.
Ở nhiệt độ thường, số lượng phân tử có đủ năng lượng để vượt qua rào cản này là rất nhỏ. Do đó, phản ứng dù có lợi về năng lượng, vẫn xảy ra với tốc độ rất chậm hoặc gần như không đáng kể.
Vai trò của nhiệt độ trong động học phản ứng
Theo phương trình Arrhenius:
\[k = Ae – \frac{{Ea}}{{RT}}\]
Tốc độ phản ứng (k) tăng nhanh theo hàm mũ với nhiệt độ (T). Khi tăng nhiệt độ, phân bố năng lượng theo Boltzmann dịch chuyển sang phải, nghĩa là số phân tử có năng lượng vượt Ea tăng lên rõ rệt. Như vậy, nhiệt độ đóng vai trò quyết định trong việc biến một phản ứng có lợi về năng lượng trở nên khả thi về tốc độ.
Gia nhiệt giúp khuếch tán và tái tổ chức mạng
Không chỉ đóng vai trò về mặt năng lượng, nhiệt độ cao còn ảnh hưởng đến cấu trúc vật lý của hệ. Trong phản ứng giữa pha rắn (FeCO₃) và khí (O₂), khuếch tán là yếu tố then chốt. Nhiệt độ cao làm tăng hệ số khuếch tán của O₂ vào trong mạng tinh thể FeO (trung gian), đồng thời giúp phá vỡ cấu trúc cũ và hình thành cấu trúc mới.
Tái tổ chức mạng tinh thể từ cấu trúc cubic sang rhombohedral đòi hỏi sự tái phân bố toàn diện của các ion, điều khó xảy ra ở điều kiện thường do giới hạn về dao động mạng và độ linh động của ion.
Phản ứng nghịch và tính ổn định của sản phẩm
Vì phản ứng thuận là tỏa nhiệt và sản phẩm Fe₂O₃ có cấu trúc bền, phản ứng nghịch trở nên khó xảy ra. Để phân hủy Fe₂O₃ thành FeO và O₂ cần một lượng nhiệt lớn hoặc có mặt các chất khử mạnh như CO hoặc H₂. Điều này chứng minh rằng Fe₂O₃ là sản phẩm ổn định hơn hẳn, và việc gia nhiệt trong phản ứng thuận chỉ nhằm mục đích vượt qua rào cản động học, không phải để “thúc đẩy” phản ứng về mặt năng lượng.
Ứng dụng
Trong luyện kim:
- Fe₂O₃ là một trong những nguyên liệu quan trọng trong lò cao luyện sắt.
- Phản ứng nhiệt phân FeCO₃ có oxi là một bước sơ chế quặng siderit để chuyển sắt về dạng có thể hoàn nguyên dễ dàng.
- Giảm tạp chất hữu cơ và cacbonat trước khi đưa vào hoàn nguyên bằng CO hoặc H₂.
Trong tổng hợp vật liệu:
- Fe₂O₃ dùng làm vật liệu từ, điện tử và xúc tác dị thể.
- Fe₂O₃ nano đang được ứng dụng trong pin, xử lý môi trường và y sinh.
Trong công nghiệp hóa chất:
- Fe₂O₃ là nguyên liệu để sản xuất sắt(III) clorua, sắt(III) sunfat – các chất keo tụ trong xử lý nước.
Trong mỹ thuật và vật liệu xây dựng:
- Fe₂O₃ là sắc tố đỏ (sắt đỏ), dùng làm màu trong xi măng, gạch men và sơn.
Bài tập vận dụng
Đề bài: Một mẫu quặng chứa hỗn hợp gồm FeCO₃ và các tạp chất trơ không phản ứng (như SiO₂). Người ta nung nóng 30,00 gram mẫu quặng trong khí Oxi dư cho đến khi phản ứng hoàn toàn, thu được 13,0 gram chất rắn. Dẫn toàn bộ khí thoát ra trong quá trình nung qua dung dịch Ca(OH)₂, thu được 15,00 gram kết tủa.
Yêu cầu:
a) Viết các phương trình phản ứng xảy ra.
b) Tính phần trăm khối lượng FeCO₃ có trong mẫu quặng ban đầu.
c) Tính khối lượng dung dịch Ca(OH)₂ đã sử dụng.
Giải:
a) Phương trình hóa học:
\[4FeCO_3 + O_2 \xrightarrow{\Delta} 2Fe_2O_3 + 4CO_2 \uparrow (1)\]
\[CO_2 + Ca(OH)_2 \to CaCO_3 \downarrow (2)\]
\[2CO_2 + Ca(OH)_2 \to Ca(HCO_3)_2 (3)\]
b) Phần trăm khối lượng FeCO₃:
Áp dụng định luật bảo toàn khối lượng, ta có khối lượng hao hụt sau phản ứng là khối lượng khí CO₂ thu được:
\[m_{CO_2} = m_{FeCO_3} + m_{O_2} – m_{Fe_2O_3} = m_{O_2} + 30 – 13 = m_{O_2} + 7 (gram)\]
Theo phương trình (1), ta có:
\[n_{CO_2} = 4n_{O_2}\]
gọi số mol của CO₂ là x, ta có:
\[44x = 36 \times \frac{1}{4}x + 7 \Rightarrow x = 0,2 (mol)\]
\[n_{FeCO_3} = n_{CO_2} = 0,2 (mol)\]
\[m_{FeCO_3} = 0,2 \times 116 = 23,2 gram\]
\[%m_{FeCO_3} = \frac{23,2}{30} \times 100 = 77%\]
c) Khối lượng dung dịch Ca(OH)₂ đã sử dụng:
\[n_{CaCO_3} = \frac{15}{100} = 0,15 mol\]
\[n_{CO_2 (2)} = n_{CaCO_3} = 0,15 mol\]
\[n_{CO_2 (3)} = 0,2 – 0,15 = 0,05 mol\] \[n_{Ca(OH)_2} = n_{CO_2 (2)} + \frac{1}{2} n_{CO_2 (3)} = 0,15 + \frac{1}{2} \times 0,05 = 0,175 mol\]
\[m_{Ca(OH)_2} = 0,175 \times 74 = 12,95 gram\]

