Kali clorat (KClO₃) là muối oxy hoá mạnh chứa clo ở trạng oxy hoá cao nhất (+5), khi tác dụng với axit mạnh và có tính khử như axit clohidric (HCl) sẽ tạo thành khí clo (Cl₂), muối KCl và nước. Đây là phản ứng oxi hóa – khử tiêu biểu, trong đó clo vừa bị oxi hóa vừa bị khử.

Phương trình hóa học
\[KClO_3 + HCl \to KCl + Cl_2 \uparrow + H_2O\]
Cân bằng phương trình:
\[KClO_3 + 6HCl \to KCl + 3Cl_2 \uparrow + 3H_2O\]
Điều kiện phản ứng
Phản ứng xảy ra ở nhiệt độ thường,
Tuy nhiên cần đảm bảo môi trường dung dịch axit có nồng độ đủ mạnh để cung cấp lượng ion H⁺ cần thiết.
KClO₃ cần được sử dụng ở dạng tinh thể hoặc dung dịch bão hòa. Do phản ứng sinh ra khí Cl₂ có tính độc, việc thực hiện cần thực hiện trong tủ hút khí hoặc nơi thông thoáng.
Các điều kiện cụ thể:
- Nhiệt độ: khoảng 25 – 40 độ C
- Môi trường: axit HCl đặc hoặc dung dịch HCl có nồng độ ≥ 6 M
- Tránh tiếp xúc trực tiếp, cần có hệ thống dẫn khí hoặc hấp thụ khí
Nguyên lý phản ứng
Phản ứng này là phản ứng điển hình cho cơ chế phản ứng oxi hóa khử nội phân tử giữa hai dạng clo ở hai trạng thái oxi hóa khác nhau. Ion H⁺ từ HCl đóng vai trò làm môi trường thuận lợi cho quá trình khử ClO₃⁻ và cung cấp điện tích để ổn định sự hình thành nước.
Phản ứng là quá trình oxi hóa-khử:
- Ion Cl⁻ trong HCl bị oxi hóa tăng trạng thái oxi hóa từ -1 lên 0: Cl⁻ → Cl₂
- Clo trong ClO₃⁻ bị khửa từ +5 xuống 0: ClO₃⁻ → Cl₂
Cân bằng theo quá trình e:
\[ClO_3^- + 6H^+ + 5e \to \frac{1}{2}Cl_2 + 3H₂O\]
\[Cl^- to \frac{1}{2}Cl_2 + e\]
Tỷ lệ đồng điện: 1:5, ta nhân để triệt tiêu e được: 1 ClO₃⁻ và 5Cl⁻ → 3Cl₂
Tổng quát: \[ClO_3^- + 5Cl^- + 6H^+ \to 3Cl_2 \uparrow + 3H_2O\]
Cách thực thực hiện phản ứng
Chuẩn bị
- Dung dịch axit clohidric: Sử dụng HCl đặc hoặc pha loãng đến nồng độ từ 6 M trở lên
- Muối kali clorat: Dạng tinh thể khan hoặc dung dịch bão hòa
- Thiết bị: cốc thủy tinh chịu axit, ống dẫn khí, hệ thống hút khí hoặc dung dịch hấp thụ khí clo (như NaOH hoặc dung dịch KI)
- Trang bị bảo hộ: găng tay cao su, kính bảo hộ, khẩu trang hoặc mặt nạ chống độc
Tiến hành
- Cho khoảng 1 gam KClO₃ vào cốc thủy tinh chứa sẵn 10 – 15 mL HCl đậm đặc
- Quan sát hiện tượng sủi bọt và xuất hiện khí màu vàng lục nhạt
- Thu khí Cl₂ bằng cách dẫn qua dung dịch hấp thụ hoặc thu vào ống nghiệm úp ngược nếu muốn chứng minh sự xuất hiện clo
Lưu ý
- Tuyệt đối không đun nóng hỗn hợp, vì KClO₃ là chất oxy hóa mạnh, có thể gây nổ khi bị nhiệt phân trong môi trường axit
- Không trộn trực tiếp KClO₃ với chất khử hoặc các hợp chất dễ cháy
- Luôn thực hiện phản ứng trong tủ hút khí có thông gió tốt
Việc thực hiện phản ứng cần tuân thủ nghiêm ngặt các nguyên tắc an toàn.
Nhận biết phản ứng
Dấu hiệu phản ứng xảy ra
Xuất hiện khí màu vàng lục nhạt, mùi sốc đặc trưng của khí clo
Hỗn hợp nóng lên nhẹ do tỏa nhiệt
Nếu thu khí Cl₂ vào dung dịch hồ tinh bột chứa KI, dung dịch sẽ chuyển màu xanh tím (do I₂ sinh ra phản ứng với hồ tinh bột)
Nhận biết sản phẩm
Khí Cl₂: Nhận biết bằng mùi, màu sắc, và khả năng oxi hóa. Dẫn Cl₂ vào dung dịch KI tạo I₂, nhận biết bằng màu xanh của hồ tinh bột.
KCl: Có thể kiểm tra bằng phản ứng kết tủa với AgNO₃ (tạo kết tủa trắng AgCl tan trong NH₃)
H₂O: Xác nhận bằng sự ngưng tụ hơi nước trên thành ống hoặc đo độ ẩm tương đối tăng trong bình phản ứng kín
Chi tiết cơ chế phản ứng cấp độ phân tử KClO₃ + HCl
Cấu trúc phân tử của ClO₃⁻ và tính chất định hướng phản ứng
Cấu trúc hình học và phân bố điện tích
Ion ClO₃⁻ có cấu trúc dạng chóp tam giác (trigonal pyramidal), trong đó clo trung tâm (số oxi hóa +5) liên kết với ba nguyên tử oxy bằng ba liên kết Cl=O có đặc tính cộng hưởng (nửa đơn nửa đôi). Góc liên kết O–Cl–O vào khoảng 106–108 độ, tương tự góc phân tử NH₃, vì có một cặp electron chưa liên kết tại nguyên tử Cl.
Đây là cấu trúc có tính cộng hưởng cao với phân bố mật độ điện tích âm chủ yếu tại các nguyên tử O, trong khi nguyên tử Cl mang điện tích dương cục bộ, tạo thành trung tâm điện dương có tính hút electron rất mạnh.
Tính oxi hóa mạnh của Cl trong ClO₃⁻
Nguyên tử Cl ở mức oxi hóa +5 có mức năng lượng thấp và trống orbital p hoặc d để nhận electron. Vì vậy, nó có xu hướng nhận electron từ các chất khử như Cl⁻ để khử về mức oxi hóa thấp hơn, thậm chí về Cl(0) ở trạng thái Cl₂.
Cơ chế nhận electron: Từ Cl⁻ sang ClO₃⁻
Môi trường và điều kiện
Trong dung dịch HCl đặc, HCl phân ly hoàn toàn thành H⁺ và Cl⁻, tạo môi trường đậm đặc ion Cl⁻, còn ClO₃⁻ từ KClO₃ tan trong dung dịch hoạt động như chất nhận e.
Cơ chế tương tác điện tử
Khi ion Cl⁻ đến gần ClO₃⁻, có hai yếu tố tương tác:
- Lực hút tĩnh điện giữa Cl⁻ và Cl (δ⁺) trong ClO₃⁻.
- Trao đổi điện tử: Một cặp e⁻ của Cl⁻ bị hút về trung tâm Cl (trong ClO₃⁻) do hiệu điện tích và độ trống orbital dπ-pπ tại Cl.
Electron từ Cl⁻ không chuyển thẳng vào Cl trung tâm một cách đơn lẻ mà đi qua quỹ đạo liên kết π (anti-bonding)* giữa Cl–O, làm giảm mật độ liên kết Cl=O, dẫn đến:
- Kéo dài liên kết Cl–O
- Phân cực và cắt đứt liên kết, giải phóng nguyên tử O về dạng H₂O (sau khi kết hợp với H⁺)
Điều này giải thích vì sao sự nhận electron của ClO₃⁻ đồng thời thúc đẩy sự cắt liên kết Cl–O: electron không đi vào Cl riêng lẻ, mà làm mất ổn định hệ phối tử Oxy, phá vỡ toàn bộ cấu trúc oxy hóa.
Cơ chế đứt liên kết Cl–O: Phối hợp nội phân tử và tấn công từ bên ngoài
Khi Cl⁻ truyền electron vào hệ ClO₃⁻, orbital π* (chống liên kết Cl–O) được điền đầy.
Quá trình này kích hoạt:
- Sự rút electron mạnh từ O về Cl
- Đứt gãy liên kết Cl–O theo kiểu heterolytic (không đều), trong đó O nhận cặp e⁻ và rời khỏi hệ, Cl giảm số oxi hóa.
Vì có ba nguyên tử O, nên cần nhiều electron (tối đa 6e⁻) để cắt toàn bộ hệ Cl–O và hạ Cl từ +5 về 0.
Sự cắt lần lượt ba liên kết Cl–O được hỗ trợ bởi sự tiếp xúc đồng thời với nhiều Cl⁻ trong môi trường HCl đặc, không phải là quá trình một bước, mà là phản ứng nhiều giai đoạn, bán đồng thời.
Tổng kết quá trình: Phân tử ClO₃⁻ → Cl(0)
Phân tử ClO₃⁻ cần nhận 5 electron để biến thành Cl(0) trong Cl₂, không phải về Cl⁻ như nhiều phản ứng đơn giản khác.
Sự mất ổn định của cấu trúc ClO₃⁻ sau khi nhận e⁻ sẽ dẫn đến đứt cả ba liên kết Cl–O, và Cl trở thành nguyên tử trung hòa, sau đó bắt cặp thành Cl₂.
Axit Clohydric HCl – Nâng cao
HCl, khi nhìn từ góc độ cấu trúc phân tử và nguyên lý điện tử, không chỉ là một axit mạnh thông thường, mà còn là một phân tử có khả năng:
- Phân ly mạnh mẽ do liên kết phân cực và moment lưỡng cực lớn
- Thể hiện vai trò chất khử gián tiếp thông qua Cl⁻ trong môi trường acid mạnh
- Tương tác điện tử đa dạng trong môi trường không nước hoặc trong xúc tác dị thể
Chính những yếu tố này khiến HCl trở thành một phân tử nền tảng trong hóa học vô cơ, hóa học acid – base, xúc tác hữu cơ, và thậm chí trong vật lý chất khí.
Cấu trúc phân tử và bản chất liên kết H–Cl
Phân tử HCl gồm một nguyên tử hydro và một nguyên tử clo liên kết cộng hóa trị qua một cặp electron dùng chung. Tuy nhiên, do clo có độ âm điện lớn hơn nhiều so với hydro, liên kết H–Cl là liên kết có cực rất mạnh, thậm chí có thể xem gần giống liên kết ion trong môi trường phân cực cao.

Liên kết H–Cl có năng lượng liên kết khoảng 431 kJ/mol và chiều dài liên kết khoảng 127 pm. Do đó, liên kết này không chỉ mạnh mà còn dễ bị phân cực điện tử, tạo ra moment lưỡng cực lớn (~1.08 D). Chính moment lưỡng cực này làm cho HCl:
- Dễ tan trong dung môi phân cực, như nước, methanol…
- Tương tác mạnh với các phân tử có cặp electron tự do (như H₂O, NH₃) qua tương tác tĩnh điện hoặc hydrogen bond (dù yếu)
- Dễ dàng phân ly proton nếu môi trường có tính phân cực đủ cao hoặc có khả năng nhận proton tốt
Về mô hình orbital, liên kết H–Cl hình thành từ sự xen phủ giữa orbital 1s của hydro với 3p của clo. Tuy nhiên, phần lớn mật độ điện tử liên kết bị kéo lệch về phía Cl, dẫn đến trạng thái “tương tự ion hóa một phần” ngay cả ở pha khí.
Phân tích cơ chế ion hóa – proton hóa
Điểm đặc biệt của HCl là khả năng ion hóa hoàn toàn trong dung môi có hằng số điện môi cao như nước. Trong trường hợp này, bản chất phân tử HCl không còn được duy trì – liên kết H–Cl bị phá vỡ hoàn toàn và tạo ra:
- Ion H₃O⁺ – chứ không phải đơn thuần là H⁺
- Ion Cl⁻ – bền, ổn định nhờ bán kính lớn và khả năng phân tán điện tích cao
\[HCl + H_2O \to H_3O^+ + Cl^-\]
Quá trình này không chỉ là “một phản ứng acid–base” mà là quá trình phân tách điện tử hoàn toàn của liên kết phân cực. Điều này dẫn đến một hệ quả quan trọng: HCl không tồn tại dưới dạng phân tử trong nước, mà chuyển toàn bộ thành ion. Đó là lý do vì sao HCl được gọi là axit mạnh tuyệt đối – nó không có cân bằng phân ly, mà tồn tại hoàn toàn ở trạng thái ion.
Tính chất đặc biệt: khả năng khử gián tiếp qua Cl⁻
Ở trạng thái bình thường, Cl⁻ là một ion bền, có bán kính lớn và vỏ electron đầy (cấu hình [Ne]3s²3p⁶), nên khó bị oxy hóa. Tuy nhiên, nếu đi cùng HCl trong môi trường có chất oxy hóa mạnh, đặc biệt là trong acid mạnh, ion Cl⁻ có thể bị lôi kéo electron và bị oxy hóa thành Cl₂:
Ví dụ, trong môi trường có KMnO₄ hoặc HNO₃ đặc:
- \[2Cl^- \to Cl_2 + 2e\] (Cl⁻ bị mất electron)
- Mn⁷⁺ hoặc N⁵⁺ nhận electron
Phản ứng này xảy ra không phải vì HCl là chất khử tốt, mà do Cl⁻ dễ bị phân cực mạnh trong môi trường proton hóa cao, khiến khả năng cho electron của nó được “mở khóa”.
→ Đây là hiện tượng đặc biệt: HCl thể hiện vai trò chất khử không trực tiếp bằng H⁺, mà thông qua Cl⁻ – điều không thường thấy ở các axit vô cơ khác như H₂SO₄ hay HNO₃.
Tính chất độc đáo trong môi trường không nước (acid khan)
Khi phân tích HCl trong môi trường không chứa nước, ví dụ như trong CO₂ lỏng, CH₃COOH khan hoặc CCl₄, tính chất của HCl thay đổi đáng kể. Vì không có dung môi để ổn định proton, liên kết H–Cl không dễ phân ly, và HCl khi ấy trở thành một acid yếu hơn rất nhiều.
Tuy nhiên, trong những môi trường như SO₂ lỏng (axit không proton), HCl có thể đóng vai trò chất proton hóa hoặc tạo ion HSO₃Cl⁺ thông qua các phản ứng điện ly dị thường. Điều này phản ánh tính linh hoạt của phân tử HCl – tùy thuộc môi trường mà nó có thể điều chỉnh mức độ ion hóa.
Ngoài ra, HCl trong các môi trường hữu cơ (như benzen, toluen) không còn là axit mạnh nữa, vì liên kết H–Cl trở nên bền hơn do không có lực phân cực từ dung môi để phá vỡ nó. HCl gần như không phân ly, từ đó không còn thể hiện tính axit mạnh. Điều này cho thấy tính axit của HCl phụ thuộc vào môi trường dung môi và khả năng ổn định của ion H₃O⁺.
Tính chất không bền vững của phức HCl – AlCl₃ và vai trò ưu thế của Cl⁻ trong tạo phức [AlCl₄]⁻
Mặc dù trong giáo trình phổ thông và một số tài liệu cơ sở có nêu rằng HCl có thể “tương tác” với AlCl₃ để tạo thành [AlCl₄]⁻, nhưng khi xét kỹ trên góc độ hóa học lượng tử, ái lực điện tử và năng lượng liên kết, thì thực tế phức giữa phân tử HCl và AlCl₃ là không bền và khó tồn tại dưới dạng ion hóa rõ rệt.

Phức giả định có dạng HAlCl₄ – nơi một phân tử HCl “gắn” vào AlCl₃ – đã được khảo sát thông qua các tính toán ab initio (theo nghiên cứu của Grubisic et al., 2010). Kết quả cho thấy:
- Liên kết giữa HCl và AlCl₃ là liên kết rất yếu, chủ yếu là lực Van der Waals hoặc tương tác tĩnh điện yếu.
- Tổng năng lượng tương tác HCl···AlCl₃ chỉ vào khoảng 8 kcal/mol, thấp hơn rất nhiều so với tương tác giữa muối ion Cl⁻ và AlCl₃ khác (khoảng 55 Kcal/mol đối với phức NaAlCl₄).
Ngược lại, khi dùng các muối halogenua kiềm như LiCl, NaCl, KCl, phản ứng tạo phức xảy ra rõ rệt và ổn định:
\[AlCl_3 + Cl^- \to [AlCl_4]^- M^+\]
Với muối NaCl điển hình, năng lượng tương tác ước tính là khoảng 55 kcal/mol, cao hơn gần 7 lần so với tương tác với HCl. Điều này chứng minh:
- Ion Cl⁻ có năng lực cho điện tử vượt trội so với phân tử HCl trung tính, do đã sẵn sàng cung cấp cặp electron cho orbital trống của Al³⁺ trong AlCl₃ (chưa đủ 8 electron hoá trị).
- Trong khi đó, phân tử HCl không có lone pair sẵn sàng tặng trực tiếp, mà electron liên kết H–Cl bị phân cực nhưng vẫn thuộc về một hệ liên kết bền, nên khó phân tách để hình thành phức ion thực sự.
Thêm vào đó, phân tử HAlCl₄ giả định được cho là không ổn định về mặt hình học và điện tử, vì HCl chỉ “hút tạm thời” vào bề mặt phẳng của AlCl₃ chứ không hình thành một liên kết hóa học rõ rệt. Nó chỉ là một phức cộng hợp yếu kiểu H-bond (hydrogen bonding-like), thay vì một anion thực sự bền [AlCl₄]⁻ như trong hệ có ion Cl⁻ thật sự.
Trích dẫn nguồn học liệu: Sikorska, C., Freza, S., & Skurski, P. (2010). The reason why HALCL4 acid does not exist. The Journal of Physical Chemistry A, 114(5), 2235–2239. https://doi.org/10.1021/jp910589m
Tính chất của HCl khí – phản ứng và hấp phụ phân tử
HCl ở pha khí (HCl(g)) mang đầy đủ moment lưỡng cực, có thể tương tác với:
- Các phân tử phân cực khác qua liên kết hydrogen yếu
- Các bề mặt kim loại, oxit, vật liệu gốm – hấp phụ và phân ly electron
Trong xúc tác dị thể (heterogeneous catalysis), HCl có thể bị hấp phụ lên bề mặt vật liệu mang điện tích dương (như alumina, silica hoạt hóa), sau đó bị ion hóa thành H⁺ và Cl⁻ trên bề mặt, gây nên hiệu ứng acid bề mặt → một hiện tượng đặc biệt được sử dụng trong công nghiệp cracking, chlorination, hoặc điều chế polymer.
Một số phản ứng ít gặp nhưng đặc biệt
- Phản ứng tạo Cl₂ với H₂O₂
HCl phản ứng với hydrogen peroxide tạo ra khí clo:
\[2HCl + H_2O_2 \to Cl_2 + 2H_2O\]
Cơ chế ở đây là H₂O₂ oxi hóa Cl⁻ trong môi trường acid, và tạo ra Cl₂ – phản ứng đặc biệt không xuất hiện trong chương trình phổ thông nhưng có ý nghĩa lớn trong phòng thí nghiệm điều chế clo sạch.
- Phản ứng thế với muối bạc và phản ứng kết tinh chọn lọc
HCl có thể tách các ion dương khỏi muối clorua của kim loại nặng như Ag⁺, Hg⁺ thông qua phản ứng kết tủa đặc trưng:
\[HCl + AgNO_3 \to AgCl \downarrow + HNO_3\]
Tuy là phản ứng cơ bản, nhưng nếu xem xét sâu hơn, đây là hiện tượng đặc biệt liên quan đến độ tan cực thấp của AgCl – chỉ khoảng 10⁻⁵ mol/L – khiến phản ứng mang tính chọn lọc cao, được dùng trong phân tích định tính ion halogen.
Phản ứng HCl với các axit chứa oxi của clo (HClOₓ)
Các axit HClOₓ (x = 1,2,3,4) có clo ở mức oxi hóa +1 → +7, nên có tính oxi hóa mạnh. Khi HCl (có Cl ở -1) phản ứng với các chất này, sẽ xảy ra phản ứng tự oxi hóa – tự khử (disproportionation) nếu điều kiện phù hợp:
HCl + HClO hoặc HClO₂
Đây là phản ứng đặc trưng của dung dịch nước Javel (NaClO + HCl):
\[HCl + HClO \to Cl_2 \uparrow + H_2O\]
Clo trong ClO⁻ (mức oxi hóa +1) bị khử về Cl⁻, trong khi Cl⁻ từ HCl bị oxi hóa thành Cl₂.
HCl + HClO₃ hoặc HClO₄
Với HClO₃ hoặc HClO₄, phản ứng tương tự có thể xảy ra nhưng thường không thuận lợi về động học. HClO₃ và HClO₄ là chất oxy hóa cực mạnh, nhưng phản ứng của chúng với HCl đơn thuần hiếm xảy ra trong điều kiện thường vì dễ tạo ra hỗn hợp phản ứng mạnh nổ.
Ví dụ:
\[5HCl + HClO_3 \to 3Cl_2 \uparrow + 3H_2O\]
Tuy nhiên, phản ứng này chỉ xảy ra trong điều kiện khan hoặc xúc tác acid mạnh, vì HClO₃ không bền trong dung dịch loãng (dễ phân hủy). Với HClO₄, phản ứng hiếm hơn do tính ổn định cao và ái lực mạnh với proton.
Tổng quan xu hướng phản ứng:
- HCl có thể tác dụng với các oxoacid của clo bậc thấp (HClO, HClO₂) để tạo ra Cl₂ và nước.
- Với các bậc cao hơn (HClO₃, HClO₄), phản ứng thường không thuận lợi trừ khi có xúc tác mạnh và điều kiện khan.
- Mọi phản ứng này đều là nội phản ứng redox giữa các dạng oxi hóa khác nhau của clo, có thể xảy ra trong hệ thống đóng kín (ví dụ: môi trường clo hóa).
Phản ứng điều chế HCl trong công nghiệp
Phản ứng công nghiệp phổ biến nhất: đốt clo và hydro
\[Cl_2 + H_2 \xrightarrow{\Delta H<0} 2HCl \quad (ΔH < 0, tỏa nhiệt)\]
Phản ứng xảy ra ở nhiệt độ thường, nhưng cần ánh sáng hoặc tia lửa để khơi mào vì có tính chất chuỗi gốc tự do. Phản ứng này rất sạch, hiệu suất cao, và được dùng để sản xuất HCl khí khan.
Ưu điểm:
- Không tạo sản phẩm phụ
- HCl thu được có độ tinh khiết cao, dễ hóa lỏng hoặc hấp thụ vào nước
Phản ứng phụ trong công nghiệp clo hóa hữu cơ
HCl cũng là sản phẩm phụ quan trọng trong nhiều phản ứng clo hóa hydrocarbon:
\[CH_4 + Cl_2 \to CH_3Cl + HCl\]
Quá trình sản xuất vinyl clorua, PVC, cloroethane,… đều sinh ra HCl. Trong ngành công nghiệp lớn, HCl được thu hồi từ khí thải và được sử dụng để điều chế HCl kỹ thuật hoặc axit clohidric thương mại.
Tính chất vật lý đặc biệt
Một đặc điểm hiếm thấy của HCl là tồn tại ở cả ba trạng thái vật lý. Ở dạng khí, HCl là khí không màu, mùi hắc, nặng hơn không khí và tan cực tốt trong nước. Ở điều kiện áp suất cao, nó có thể bị hóa lỏng ở -85 °C, và thậm chí tồn tại ở dạng rắn dưới -114 °C. Độ tan rất cao trong nước (725g/L ở 0°C) tạo ra dung dịch axit rất đậm đặc, thường được dùng dưới tên gọi “axit clohidric đậm đặc”.
Kali Clorat (KClO₃) – Nâng cao
Kali clorat là một muối ion, gồm ion K⁺ (kali) và anion ClO₃⁻ (clorat). Cấu trúc tinh thể của KClO₃ thuộc dạng orthorhombic ở nhiệt độ phòng, trong đó:
- Ion K⁺ là ion đơn giản, không có tính oxy hóa–khử, chủ yếu đóng vai trò ổn định điện tích.
- Ion ClO₃⁻ là anion đa nguyên tử, trong đó nguyên tử clo có mức oxi hóa +5, liên kết với ba nguyên tử oxy.
Ion ClO₃⁻ có cấu trúc cộng hưởng, với ba liên kết Cl–O có độ dài xấp xỉ nhau do sự phân bố đều electron. Điều này mang lại một mức độ ổn định tương đối cho anion, nhưng vẫn giữ được tính oxy hóa mạnh vì clo có thể nhận electron để khử về Cl⁻ (mức oxi hóa -1).
Cấu trúc hình học tổng thể là hình chóp đáy tam giác (trigonal pyramidal) với clo ở đỉnh. Góc giữa các liên kết xấp xỉ 106–108 độ, do ảnh hưởng từ cặp electron chưa liên kết trên oxy và mật độ điện tích lớn quanh nguyên tử clo.
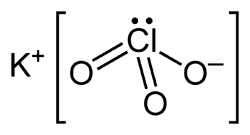
Điều đặc biệt là do clo ở mức oxi hóa trung gian (+5), nên anion ClO₃⁻ có tiềm năng tham gia các phản ứng oxi hóa–khử hai chiều: có thể bị khử về Cl⁻ hoặc oxi hóa tiếp lên Cl⁷⁺ trong ClO₄⁻. Tuy nhiên, do năng lượng ion hóa cao, ClO₃⁻ thường chỉ bị khử trong các phản ứng thường gặp.
Tính chất hóa học đặc biệt của KClO₃
Tính oxy hóa mạnh và phản ứng với chất khử
Nguyên tử clo trong KClO₃ có mức oxi hóa +5. Mức oxi hóa này cho phép clo nhận tới 6 electron để khử về mức -1 trong ion Cl⁻. Do vậy, phân tử KClO₃ có xu hướng nhận electron từ các chất khác (đặc biệt là chất khử), biểu hiện tính chất của một chất oxi hóa mạnh.
Ví dụ:
\[KClO_3 + 3H_2S \to KCl + 3S \downarrow + 3H_2O\]
Tuy không mạnh bằng ClO₄⁻ hay KMnO₄, nhưng ClO₃⁻ là một chất oxi hóa có cơ chế mềm hơn so với ClO₄⁻:
- ClO₄⁻ có mức oxi hóa +7 và liên kết Cl–O cực kỳ bền cản trở khả năng tham gia phản ứng oxi hóa nếu không có điều kiện đặc biệt.
- ClO₃⁻ có liên kết Cl–O kém bền hơn, dẫn đến khả năng phản ứng dễ xảy ra hơn, nhưng cũng khiến phân tử dễ bị phân hủy.
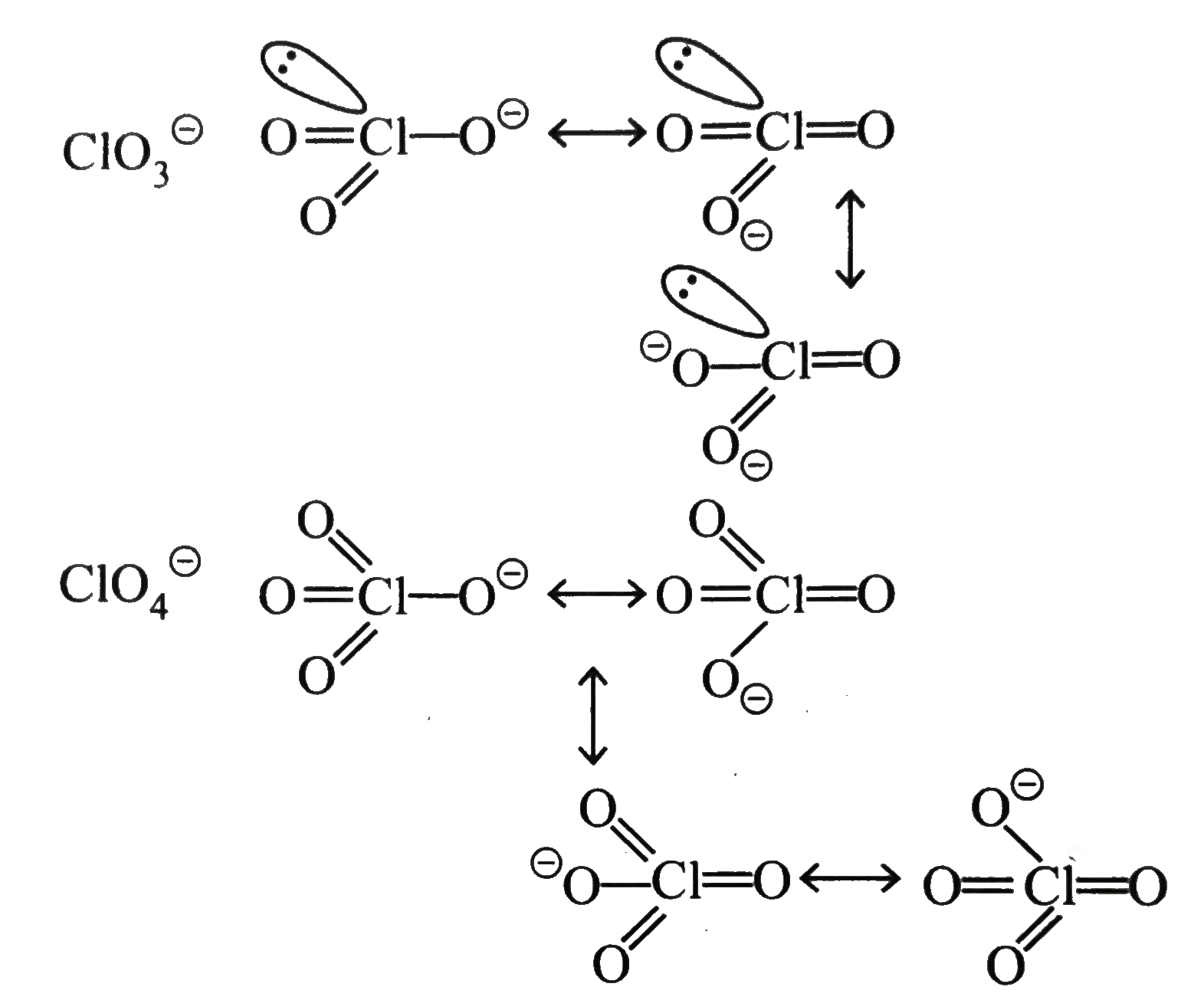
KClO₃ là một chất oxy hóa mạnh, đặc biệt trong điều kiện nhiệt độ cao hoặc khi kết hợp với chất khử hữu cơ hay vô cơ. Nguyên nhân là vì clo trong ClO₃⁻ có xu hướng nhận thêm electron để trở thành Cl⁻.
Khi bị khử, ClO₃⁻ đóng vai trò hút electron, trong khi chất khử (như S, P, C, đường, bột gỗ…) đóng vai trò nhường electron. Phản ứng giữa KClO₃ và chất khử giải phóng năng lượng lớn, có thể xảy ra đột ngột và gây cháy hoặc nổ.
Ví dụ tiêu biểu:
KClO₃ phản ứng với đường (C₆H₁₂O₆) trong môi trường có xúc tác như H₂SO₄ đặc sẽ tạo ra CO₂, H₂O, KCl và giải phóng nhiều nhiệt.
\[4KClO_3 + C_6H_12O_6 \xrightarrow{H_2SO_4 (đặc)} 4KCl + 6CO_2 \uparrow + 6H_2O\]
Đây là cơ sở cho phản ứng nổ clorat, hay được dùng trong các pháo hoa, diêm cháy không cần gió, thuốc nổ khô.
Phản ứng phân hủy nhiệt
KClO₃ khi đun nóng có thể phân hủy theo hai hướng khác nhau, tùy có mặt xúc tác hay không:
- Không có xúc tác, phản ứng phân hủy chủ yếu tạo KCl và O₂:
Ba phân tử KClO₃ phân hủy tạo ra hai phân tử KCl và ba phân tử khí oxy. - Có xúc tác MnO₂, phản ứng xảy ra ở nhiệt độ thấp hơn và hiệu quả cao hơn, thường được dùng trong phòng thí nghiệm để điều chế khí oxy.
Cơ chế phản ứng liên quan đến sự khử Cl⁵⁺ về Cl⁻ và sự tách oxy từ các liên kết Cl–O, trong đó phân tử KClO₃ vừa là nguồn oxy vừa là chất tự oxi hóa.
\[KClO_3 \xrightarrow{\Delta t} KCl + \frac{3}{2} O_2 \uparrow\]
Đây là phản ứng oxi hóa–khử nội phân tử, trong đó chính anion ClO₃⁻ vừa bị khử vừa cung cấp nguyên tử oxy.
Phản ứng với axit mạnh và nguy cơ nổ
KClO₃ có thể phản ứng với các axit mạnh như HCl hoặc H₂SO₄ đặc. Trong môi trường này, ion ClO₃⁻ bị proton hóa hoặc bị khử bởi Cl⁻ từ HCl, tạo ra Cl₂, nước và KCl. Đây là phản ứng oxi hóa–khử hỗn hợp giữa hai dạng oxy hóa của clo.
Phản ứng:
\[KClO_3 + 6HCl \to KCl + 3Cl_2 + 3H_2O\]
Phản ứng này rất dễ gây nổ nếu cô cạn dung dịch, do sự xuất hiện của khí clo, oxi và lượng nhiệt lớn được sinh ra. Hơn nữa, H₂SO₄ đặc có thể làm khô ClO₃⁻, khiến ion này mất ổn định và phân hủy đột ngột.
Tính axit–bazơ trong phản ứng với kiềm hoặc axit
Dù là muối của axit mạnh (HClO₃) và bazơ mạnh (KOH), nhưng ClO₃⁻ không bị thủy phân trong nước. Tuy nhiên, trong môi trường kiềm mạnh (dư KOH), ClO₃⁻ có thể tham gia phản ứng oxi hóa–khử, bị khử thành Cl⁻ hoặc oxi hóa thành ClO₄⁻ trong điều kiện điện phân hoặc có xúc tác.
Trong một số phản ứng khử đặc biệt, ClO₃⁻ có thể biến đổi thành ClO₂⁻, Cl⁻ hoặc ClO⁻, tùy thuộc vào điều kiện pH và chất khử.
HClO₃ có thể tác dụng với kim loại hoạt động (như Zn, Fe) trong môi trường axit để tạo Cl⁻ và muối oxi hóa khử.
\[3Zn + ClO_3^- + 6H^+ \to 3Zn^{2+} + Cl^- + 3H_2O\]
Ngoài ra, có thể oxy hóa muối sắt(II) thành sắt(III):
Khi trộn HClO₃ với dung dịch muối sắt (II) hoặc các chất khử như H₂S, phản ứng oxi hóa xảy ra do sự chênh lệch thế oxi hóa–khử. Clo từ +5 bị khử xuống Cl⁻, còn Fe²⁺ bị oxi hóa thành Fe³⁺, H₂S thành S⁰, v.v…
Sự chênh lệch này được hỗ trợ bởi đặc tính phân cực của HClO₃ và khả năng phân ly tốt, giúp clo dễ tiếp nhận electron từ các chất khử trong môi trường nước.
\[6Fe^{2+} + ClO_3^- + 6H^+ \to 6Fe^{3+} + Cl^- + 3H_2O\]
Tính chất này tương tự với các chất oxy hóa mạnh, giúp HClO₃ ứng dụng trong một số phản ứng clo hóa hoặc làm chất oxy hóa công nghiệp (dù hạn chế vì tính không ổn định).
Phản ứng hữu cơ đặc biệt
Do là chất oxi hóa mạnh và không bền, HClO₃ có thể tác dụng với các hợp chất hữu cơ như rượu, glixerol, đường, xenlulo hoặc các hợp chất dễ khử khác. Phản ứng thường rất nhanh và sinh nhiệt lớn, có thể gây cháy nổ.
Hiện tượng này xảy ra vì các nhóm –OH và nhóm –CHO trong hợp chất hữu cơ dễ bị oxi hóa, trong khi clo trong HClO₃ dễ bị khử. Nếu phản ứng xảy ra quá nhanh mà không được kiểm soát (như khi cô cạn dung dịch clorat), nhiệt sinh ra có thể đủ để gây nổ.
Phản ứng Ethanol (C₂H₅OH):
\[3C_2H_5OH + 4HClO_3 \rightarrow 3CH_3COOH + 4HCl + 5H_2O\]
Phản ứng Formaldehyde (HCHO):
\[3HCHO + 2HClO_3 \rightarrow 3HCOOH + 2HCl\]
Phản ứng Glucose (C₆H₁₂O₆):
\[C_6H_{12}O_6 + 12HClO_3 \rightarrow 6CO_2 + 6H_2O + 12HCl\]
Phản ứng với vòng thơm – Phenol (C₆H₅OH):
\[C_6H_5OH + 3HClO_3 \rightarrow C_6H_2(OH)(NO_2)_3 + 3HCl + 3H_2O\]
(Lưu ý: phản ứng này yêu cầu điều kiện mạnh và HClO₃ hoạt động như chất oxi hóa sinh NO₂⁺ trong hỗn hợp axit mạnh).
Phản ứng với các hydrocarbon (chất dễ cháy) như bột giấy, cellulose, đường:
Khi trộn với muối clorat (KClO₃) hoặc HClO₃ khan sẽ tạo ra hợp chất dễ nổ/cháy mạnh khi đốt nóng.
\[C_6H_{12}O_6 + KClO_3 \xrightarrow{\Delta} CO_2 + H_2O + KCl\]
Phản ứng với amin thơm (như anilin):
\[C_6H_5NH_2 + HClO_3 \rightarrow C_6H_5NO_2 + HCl + H_2O\]
Phản ứng với hợp chất không bền, dễ oxi hóa (như anken, alkin):
\[C_2H_4 + 3HClO_3 \rightarrow 2CO_2 + 3H_2O + HCl\]
Vì lý do này, các muối clorat (NaClO₃, KClO₃) thường được sử dụng thay vì HClO₃ tinh khiết để kiểm soát phản ứng an toàn hơn.
Tính chất vật lý đặc biệt và nguy cơ an toàn
- KClO₃ là chất rắn, tinh thể không màu, dễ tan trong nước, vị đắng.
- Khi trộn với chất hữu cơ hoặc lưu huỳnh, phospho, phản ứng cháy có thể xảy ra mạnh và đột ngột.
- Đây là một trong số ít muối tạo cháy không cần gió, do nó tự giải phóng oxy.
- Dễ nổ khi cô cạn trong dung dịch chứa axit mạnh.
- Vì tính nguy hiểm, KClO₃ ngày nay được thay thế dần bằng các chất khác như KNO₃ trong công nghiệp pháo hoa và thuốc nổ.
Khí Clo (Cl₂) – Nâng cao
Cấu trúc phân tử và bản chất điện tử của Cl₂
Phân tử khí clo gồm hai nguyên tử Cl liên kết với nhau bằng một liên kết cộng hóa trị đơn (Cl–Cl), không phân cực, vì hai nguyên tử có cùng độ âm điện.
- Cấu hình electron lớp ngoài của Cl là 3s² 3p⁵, chỉ thiếu một electron để đạt cấu hình bền của khí hiếm.
- Khi liên kết, mỗi nguyên tử Cl chia sẻ một electron để hình thành liên kết đơn Cl–Cl, đạt cấu hình bền vững giống khí hiếm (3s² 3p⁶). Tuy vậy, do có đến ba cặp electron không liên kết (non-bonding pairs) trên mỗi nguyên tử clo, mật độ điện tử quanh Cl₂ là rất lớn, tạo nên vùng điện tử đậm đặc, dễ bị phân cực.
- Liên kết Cl–Cl khá yếu, năng lượng liên kết chỉ khoảng 242 kJ/mol, thấp hơn so với liên kết O=O (498 kJ/mol), làm cho Cl₂ dễ bị phân cắt đồng ly trong nhiều phản ứng, đặc biệt dưới ánh sáng tia tử ngoại, sinh ra hai gốc tự do Cl•.
Cơ chế gốc tự do này là nền tảng hình thành tính chất hóa học nổi bật: Clo là phi kim hoạt động mạnh, dễ thu electron (oxi hóa) các chất khác để trở thành ion Cl⁻.
Tính chất vật lý nổi bật
- Khí màu vàng lục nhạt, mùi hắc, độc hại, gây ngạt
- Nặng hơn không khí, tan được trong nước tạo “nước clo”
- Dễ hóa lỏng, điểm sôi -34°C, dễ hóa lỏng trong công nghiệp
Tính oxi hóa mạnh và cơ chế phản ứng điện tử
Phản ứng với kim loại (tạo muối halogenua)
Cơ chế phản ứng giữa Cl₂ và kim loại là phản ứng oxi hóa – khử, trong đó clo bị khử từ mức oxi hóa 0 về -1, còn kim loại bị oxi hóa từ 0 lên mức dương.
Ví dụ với natri:
Bước 1: Natri nguyên tử (Na) có electron lớp ngoài 3s¹, dễ mất 1e⁻ → Na⁺
Bước 2: Phân tử Cl₂ tách đôi liên kết Cl–Cl, mỗi nguyên tử Cl nhận 1e⁻ → Cl⁻
Phản ứng tổng: \[2Na + Cl_2 \to 2NaCl\]
Phản ứng tỏa nhiệt rất mạnh, thường gây cháy. Tương tự xảy ra với Mg, Al, Fe, v.v…
Phản ứng với hiđro (tạo HCl) – Cơ chế quang hóa
Phản ứng giữa H₂ và Cl₂ xảy ra bùng nổ dưới ánh sáng theo cơ chế chuỗi radical (gốc tự do):
Giai đoạn khởi đầu (phân cắt đồng ly – homolysis):
\[Cl_2 \to 2Cl \cdot \quad (dưới tia tử ngoại)\]
Giai đoạn lan truyền:
\[Cl \cdot + H_2 \to HCl + H\cdot\]
\[H \cdot + Cl_2 → HCl + Cl \cdot\]
Chuỗi phản ứng được duy trì do Cl• và H• là gốc tự do rất hoạt động.
Giai đoạn kết thúc:
\[Cl \cdot + Cl \cdot \to Cl_2\]
\[H \cdot + H \cdot \to H_2\]
\[H \cdot + Cl \cdot \to HCl\]
Phản ứng cực kỳ mạnh, giải phóng năng lượng lớn, dễ gây cháy nổ.
Phản ứng với dung dịch kiềm – Phản ứng phân hủy không đối xứng
Tùy theo nhiệt độ và loại kiềm, Cl₂ phản ứng khác nhau.
a) Với kiềm lạnh (NaOH loãng, nhiệt độ thường):
\[Cl_2 + 2NaOH \to NaCl + NaClO + H_2O\]
Một nguyên tử clo bị khử thành NaCl, một nguyên tử bị oxi hóa thành NaClO (chứa Cl⁺).
b) Với kiềm nóng (NaOH đậm đặc, đun nóng):
\[3Cl_2 + 6NaOH → 5NaCl + NaClO_3 + 3H_2O\]
Đây là phản ứng tự oxi hóa – khử nâng cao, Cl⁻ và Cl⁵⁺ (trong ClO₃⁻) cùng xuất hiện. Phản ứng này tạo muối clorat, dùng trong tẩy trắng, pháo hoa.
Phản ứng đặc biệt của Cl₂ với các hợp chất hữu cơ theo cơ chế gốc tự do
Khi tiếp xúc với ánh sáng hoặc nhiệt, phân tử Cl₂ phân ly thành hai gốc tự do Cl•. Đây là những phân tử có electron độc thân, rất dễ phản ứng.
Ví dụ điển hình là khi khí clo tiếp xúc với metan (CH₄) trong điều kiện có ánh sáng, chuỗi phản ứng khởi phát như sau:
\[CH_4 + xCl_2 \xrightarrow{as} CH_{(4-x}}Cl_x + xHCl \quad (x = 1,2,3,4)\]
Bước khởi động: ánh sáng cung cấp năng lượng cho phân tử Cl₂, bẻ gãy liên kết Cl–Cl và tạo hai gốc Cl•
Bước lan truyền: một gốc Cl• tiếp xúc với phân tử CH₄, chiếm lấy một nguyên tử hydro bằng cách tạo liên kết Cl–H, đồng thời sinh ra gốc CH₃•
Gốc CH₃• vừa sinh ra sẽ tấn công một phân tử Cl₂ mới, chiếm lấy một nguyên tử clo, tạo thành CH₃Cl (metyl clorua) và tái tạo một gốc Cl•
Gốc Cl• mới lại tiếp tục chuỗi phản ứng, cho đến khi các gốc gặp nhau và phản ứng kết thúc
Phản ứng này có thể tiếp diễn, tạo ra CH₂Cl₂, CHCl₃ và CCl₄ tùy theo điều kiện. Điểm đặc biệt ở đây là khả năng tham gia vào chuỗi phản ứng tự duy trì của Cl₂ qua trung gian gốc tự do – điều mà không phải phi kim nào cũng làm được.
Tính chất tạo electrophile Cl⁺ trong xúc tác acid Lewis và vai trò đặc biệt trong phản ứng Friedel–Crafts
Cl₂ là một phân tử trung tính, nhưng khi tác dụng với acid Lewis mạnh như AlCl₃ (hoặc FeCl₃), một nguyên tử clo trong phân tử Cl₂ có thể nhường electron cho AlCl₃, tạo ra ion phức [AlCl₄]⁻ và một cation Cl⁺. Cation này là một electrophile rất mạnh, do clo ở đây mất electron, mang điện tích dương, và do đó có thể tấn công vào các vị trí giàu electron như vòng thơm.
Trong phản ứng thế điện tử aromatic kiểu Friedel–Crafts, ion Cl⁺ này đóng vai trò là tác nhân thế, thế vào vòng benzen để tạo ra clorobenzen. Cl₂ bản thân không thể tấn công trực tiếp vào vòng thơm nếu không có acid Lewis tạo ra Cl⁺. Việc Cl₂ có thể phân cực đến mức tạo ra Cl⁺ nhờ xúc tác cho thấy đây là một phân tử có tiềm năng phân cực cao, phản ứng linh hoạt.
\[Cl_2 + C_6H_6 \xrightarrow{AlCl_3/FeCl_3} C_6H_5Cl + HCl
Cơ chế:
- AlCl₃ là acid Lewis, nhận 1 Cl⁻ từ Cl₂, tạo cation Cl⁺
- Cl⁺ là electrophile mạnh, tấn công vòng benzen tạo vòng thơm bị thế
- Sau đó vòng hồi phục tính thơm bằng nhả 1 proton.

Phản ứng với các hợp chất khử mạnh theo cơ chế electron nội phân tử
Cl₂ có thể phản ứng mạnh với các hợp chất có khả năng cho electron như H₂S, SO₂, hoặc ion Fe²⁺. Trong những phản ứng này, clo đóng vai trò chất oxi hóa, nhận electron để chuyển thành ion Cl⁻. Một điểm đặc biệt là nhiều trong số những phản ứng này có thể xảy ra ngay trong dung dịch, không cần xúc tác hay nhiệt độ cao.
Ví dụ, khi clo tiếp xúc với khí H₂S trong nước, một nguyên tử clo nhận electron từ lưu huỳnh trong H₂S và bị khử thành ion Cl⁻, còn lưu huỳnh bị oxi hóa thành S⁰. Điểm đặc biệt là phản ứng này rất nhanh, tỏa nhiệt, và có thể xảy ra ở điều kiện thường – điều chứng tỏ tính háo electron của Cl₂ rất mạnh, so với các phi kim cùng nhóm như Br₂ hay I₂.
Ví dụ: \[H_2S + Cl_2 \to S \downarrow + 2HCl\]
\[SO_2 + Cl_2 + 2H_2O \to H_2SO_4 + 2HCl\] Đây là các phản ứng ứng dụng trong phân tích hóa học và xử lý nước thải.
Khả năng phản ứng phân tử học đặc biệt trong môi trường nước
Một tính chất đặc trưng và đặc biệt của Cl₂ là khi hòa tan trong nước, phân tử Cl₂ không chỉ đơn thuần tan vật lý mà còn tham gia phản ứng hóa học tạo HCl và HClO. Đây là phản ứng phân tách không đối xứng, tương tự như phản ứng với kiềm nhưng xảy ra ngay trong môi trường trung tính. Một phần Cl₂ bị khử về Cl⁻ trong HCl, phần còn lại bị oxi hóa thành Cl⁺ trong HClO. Axit hypoclorơ (HClO) là một axit yếu nhưng có khả năng oxi hóa mạnh, là tác nhân sát trùng chủ lực trong nước clo.
Cơ chế phân tử có thể hình dung là một phân tử nước đóng vai trò cầu nối giữa hai nguyên tử clo, tạo môi trường phân cực và cung cấp proton để tách một nguyên tử Cl thành HCl, trong khi nhóm OH⁻ còn lại tạo liên kết với clo còn lại thành HClO.
Ứng dụng của phản ứng và sản phẩm
1. Ứng dụng của khí clo:
- Dùng để tẩy trắng sợi, vải, giấy
- Dùng trong sản xuất nước Javen, clorua vôi
- Làm nguyên liệu sản xuất hợp chất hữu cơ chứa clo (PVC, thuốc trừ sâu, chất dẻo)
- Dùng trong sát trùng, diệt khuẩn, xử lý nước
2. Ứng dụng trong lý thuyết giảng dạy:
- Phản ứng minh họa cho sự khử–oxi hóa nội phân tử
- Dùng để chứng minh tính oxi hóa mạnh của muối clorat
- Giúp học sinh thực hành các phương pháp nhận biết khí, nhận biết sản phẩm vô cơ
3. Ứng dụng trong phân tích hóa học:
- Clo sinh ra có thể sử dụng như một tác nhân oxi hóa trong phân tích iod, sắt và các chất khử khác
- Phản ứng làm tiền đề cho việc tổng hợp các dẫn xuất của clo
Bài tập vận dụng
Đề bài: Cho 1,2 mol HCl đặc tác dụng với KClO₃ dư.
a) Viết phương trình hoàn chỉnh.
b) Tính thể tích Cl₂ sinh ra ở đktc.
c) Dẫn Cl₂ vào dung dịch NaOH loãng, viết phương trình.
Giải:
a) Phương trình hóa học:
\[KClO_3 + 6HCl \to KCl + 3Cl_2 \uparrow + 3H_2O\]
b) Thể tích Cl₂ sinh ra ở đktc:
\[n_{Cl_2} = \frac{1}{2} n_{HCl} = \frac{1}{2} \times 1,2 = 0,6 (mol)\]
\[V_{Cl_2} = 22,4 \times 0,6 = 13,44 (L)\]
c) Dẫn Cl₂ vào dung dịch NaOH loãng, viết phương trình hóa học:
\[Cl_2 + 2NaOH_{(loãng)} \to NaCl + NaClO + H_2O\]
