Phương trình H2+ O2 → H2O là phương trình biểu diễn phản ứng tác dụng giữa H2 (Hidro) và O2 (Oxy) phân tử. Phản ứng trên được thực hiện ở nhiệt độ cao và H2 (Hidro) cháy trong không khí có O2 (Oxy) có thể gây nổ mạnh nên phải lưu ý khi thực hiện phản ứng hóa học.
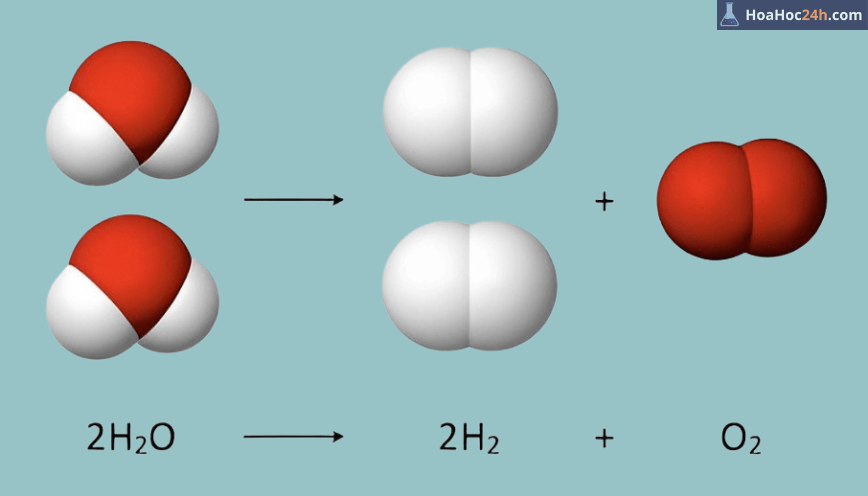
Lưu ý
Với phương trình hóa học H2+O2 không còn xa lạ gì với mỗi chúng ta. Ở phương trình phản ứng trên H2 là chất khí gọi là khí hidro còn O2 cũng là một chất khí gọi là khí oxi.
Khi cho chúng phản ứng với nhau ở nhiệt độ cao sẽ gây tiếng nổ mạnh có thể ảnh hưởng đến người làm thí nghiệm nếu không cẩn thận còn có thể gây tổn thương nghiêm trọng. Do vậy, khi thực hiện thí nghiệm này cần hết sức lưu ý.
Phương trình phản ứng hóa học
H2 + O2 → H2O
Điều kiện của phản ứng H2 + O2
Khi chúng ta trộn hỗn hợp 2 khí trên vào với nhau và để ở nhiệt độ thường sẽ không xảy ra phản ứng hóa học nào cả đâu các em. Để phản ứng hóa học xảy ra chúng ta phải mồi bằng mồi lửa để kích thích phản ứng đầu tiên xảy ra.
Tuy nhiên, sau khi phản ứng thứ 1 xảy ra sẽ sinh ra một nhiệt lượng cứ như vậy sẽ là dây chuyển phản ứng tới khi hết O2 hoặc hết H2 hoặc cả 2 khí đều hết. Do vậy, khi H2 +O2 chúng ta chỉ cần mồi chút lửa là phản ứng đã xảy ra hoàn toàn rồi.
Quan sát hiện tượng và sự thay đổi về trạng thái của các chất
| 2H2 | + | O2 | → | 2H2O |
| (khí) | (khí) | (khí) | ||
| (không màu) | (không màu) | (không màu) |
Quá trình cho và nhận electron
H – 1e → H+
O + 2e → O2-
H2 + O2 là phản ứng gì ?
→ Như đã phân tích ở trên, trong chương trình hóa học lớp 8 gọi H2+O2 là phản ứng hóa hợp từ là số chất phản ứng là 2 và số chất tạo thành là 1. Còn ở cấp học cao hơn thì gọi đây là phản ứng oxi hóa khử.
→ Như chúng ta đã biết, nước (H2O) bắt đầu cho quá trình khởi nguồn sự sống trên trái đất và các nhà khoa học đã chứng minh rằng : Ở đâu có nước, thì ở đó có khả năng cao sẽ tồn tại sự sống. Thật vậy, sau này chúng ta học Hóa Học mới nhận ra được một điều rằng trong quá trình trao đổi chất của hầu hết các phản ứng thì đều cần có nước.
Tính chất vật lý của nước (H2O)
Nước là chất lỏng không màu, không mùi, không vị. Nước sôi ở 100oC, hóa rắn ở 0oC thành nước đá và tuyết. Nước là dung môi hòa tan nhiều chất hóa học khác như đường, muối ăn . . . chất lỏng khác như cồn, acid, các chất khí như HCl, NH3
Tính chất hóa học của nước H2O
Tác dụng với kim loại
Nước có thể tác dụng với kim đứng trước H2 trong dãy điện hóa kim loại tùy thuộc vào từng điều kiện khác nhau. Ở nhiệt độ thường, nước chỉ tác dụng với kim loại đứng trước Mg bao gồm nhóm kim loại (Ia) và nhóm kim loại (IIa)
Nước tác dụng với Oxit bazơ
Nước tác dụng với Oxit bazơ tạo thành bazơ tương ứng. Một số Oxit có thể tác dụng với nước như: Na2O, K2O, BaO, CaO ở nhiều độ thường.
Phương trình phản ứng cụ thể như sau :
1. Na2O + H2O → NaOH
2. K2O + H2O → KOH
3. BaO + H2O → Ba(OH)2
4. CaO + H2O → Ca(OH)2
Nước tác dụng với một số Oxit acid
Nước có thể tác dụng với một số oxit acid như : CO2, SO2, SO3, P2O5, NO2 . . . tạo thành acid tương tứng như H2CO3, H2SO3, H2SO4, H3PO4, HNO3 . .
Phương trình phản ứng :
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
SO3 + H2O → H2SO4
P2O5 + H2O → H3PO4
NO2 + H2O → HNO3
Điều chế nước (H2O)
Điều chế nước từ oxi hay như một số câu hỏi O2 ra H2o như nào ?
Để từ nguyên tử O2 mà có thể điều chế ra được H2o thì chúng ta có thể cho O2 tác dụng với khí hidro (H2)
Phương trình phản ứng: O2 + H2 → H2O

Với đam mê truyền đạt và chia sẻ những kiến thức hóa học hữu ích với mọi người, TC Chemistry không chỉ giới hạn việc chia sẻ kiến thức hóa học từ cơ bản đến nâng cao, mà còn cung cấp câu hỏi, đề thi thử và phương trình phản ứng hóa học để giúp người đọc hiểu sâu về chủ đề và phát triển kỹ năng trong lĩnh vực này.