Phản ứng giữa CH₃COOH và KOH, nhìn dưới góc độ hóa học hữu cơ, là một quá trình khử proton do bazơ mạnh, được điều khiển bởi sự phân cực nội tại trong nhóm cacboxylic, hiệu ứng cảm ứng và cộng hưởng. OH⁻ không tấn công vào nguyên tử cacbon trong nhóm C=O mà thực hiện loại proton theo cơ chế base-axit. Ion axetat tạo thành được ổn định bởi cộng hưởng điện tử, trong khi ion K⁺ tạo liên kết ion với gốc cacboxylat. Chính cơ chế phân tử này khiến cho phản ứng xảy ra nhanh, gần như hoàn toàn, và là cơ sở để hiểu sâu hơn về cơ chế phản ứng axit-bazơ hữu cơ nói chung.
Với cấu trúc phân tử đơn giản nhưng đầy tiềm năng ứng dụng, phản ứng này là nền tảng cho nhiều nghiên cứu trong hóa học hữu cơ, hóa học phân tích và công nghiệp hóa chất.

Phương trình hóa học
\[KOH + CH_3COOH \to CH_3COOK + H_2O\]
Phương trình tự cân bằng.
Điều kiện phản ứng
Phản ứng tự phát, xảy ra ngay khi hai chất tiếp xúc nhau ở điều kiện thường.
Cách thực hiện phản ứng
Chuẩn bị:
- Cần có hai dung dịch loãng: KOH và CH₃COOH, có thể sử dụng pipet hoặc buret để đo chính xác lượng chất.
- Nếu thực hiện chuẩn độ, dung dịch CH₃COOH nên cho vào bình nón, còn dung dịch KOH nên cho vào buret để dễ kiểm soát.
Tiến hành:
- Cho từ từ KOH vào dung dịch CH₃COOH, vừa nhỏ giọt vừa khuấy đều. Nếu cần xác định điểm tương đương, có thể thêm chỉ thị phenolphthalein để quan sát.
- Phản ứng xảy ra ngay lập tức khi hai chất tiếp xúc, sinh ra nước và muối hòa tan.
Lưu ý:
- Cần kiểm soát nồng độ để tránh dung dịch quá đặc hoặc quá loãng làm sai lệch hiện tượng.
- Sử dụng chỉ thị thích hợp nếu cần theo dõi điểm trung hòa (phenolphthalein chuyển từ không màu sang hồng nhạt ở pH > 8, nên thích hợp cho nhận biết KOH dư).
- Phản ứng không sinh nhiệt mạnh nhưng có thể ảnh hưởng nhẹ đến pH dung dịch nếu tỉ lệ chất không chính xác.
Nhận biết phản ứng và sản phẩm
Nhận biết phản ứng đang xảy ra:
- Phản ứng không tạo ra chất khí hay kết tủa, nhưng có thể nhận biết bằng các dấu hiệu sau:
- Khi sử dụng chỉ thị: màu hồng nhạt của phenolphthalein sẽ biến mất khi KOH vừa đủ trung hòa axit.
- Đo pH của dung dịch: ban đầu pH axit < 7, sau phản ứng dần tăng đến gần trung tính (pH ≈ 7) tại điểm tương đương.
Nhận biết sản phẩm:
- Muối CH₃COOK tan hoàn toàn trong nước, không màu, không mùi rõ rệt.
- Nước là sản phẩm đồng thời, góp phần làm loãng dung dịch.
Tính chất hóa học Kali Hydroxide (KOH) – Nâng cao
KOH là một base ion hóa mạnh, phản ứng cực kỳ linh hoạt do sự hiện diện của OH⁻ giàu electron và K⁺ trơ, dễ tan. Nó thể hiện rõ vai trò:
- Là base mạnh trong vô cơ và hữu cơ.
- Là chất phản ứng “điểm khởi đầu” cho nhiều chuỗi tổng hợp hóa học.
- Là công cụ điều chỉnh pH, xúc tác chuyển hóa, phân tích định tính và tạo muối.
Từ góc nhìn điện tử, bản chất OH⁻ chính là “tâm phản ứng” – nơi hội tụ mật độ điện tích âm, sẵn sàng tấn công H⁺ hoặc C=O, trong khi K⁺ làm nền cho sự cân bằng điện tích và khả năng hòa tan.

Cấu trúc tinh thể và phân ly
KOH là hợp chất ion, tồn tại ở trạng thái rắn dưới dạng mạng tinh thể ion gồm các ion K⁺ và OH⁻, liên kết với nhau bằng lực hút tĩnh điện.
Khi tan trong nước, KOH phân ly hoàn toàn:
\[KOH \to K^+ + OH^-\]
Đây là quá trình không thuận nghịch trong dung dịch loãng vì năng lượng phân ly được bù đắp bằng năng lượng solvat hóa rất mạnh (đặc biệt cho ion OH⁻).
KOH là một bazơ mạnh hoàn toàn, không tồn tại phân tử KOH tự do trong dung dịch, mà chỉ có ion.

Cấu trúc điện tử và ý nghĩa hóa học
KOH là một hợp chất ion gồm hai thành phần chính: cation K⁺ (kali dương) và anion OH⁻ (hydroxit). Trong trạng thái rắn, chúng được sắp xếp thành mạng tinh thể ion thông thường, liên kết với nhau bằng lực hút tĩnh điện. Khi tan trong nước, KOH phân ly hoàn toàn thành các ion riêng biệt: K⁺ và OH⁻. Không còn tồn tại phân tử KOH ở dạng nguyên vẹn trong dung dịch loãng.
K⁺: cation nhóm IA
Cấu hình electron: [Ar] Không có electron chưa ghép đôi, không còn lớp ngoài cùng nên trơ về mặt oxi hóa – khử, chỉ tham gia các tương tác tĩnh điện (ion – ion, ion – phân cực). Bán kính lớn, mật độ điện tích thấp, dễ tan, dễ khuếch tán trong nước.
OH⁻: anion nhỏ, phân cực mạnh – Tính base cực mạnh
KOH là một trong những bazơ mạnh nhất trong hóa học, tương đương với NaOH. Khi tan trong nước, nó tạo thành dung dịch có pH gần 14, tức là môi trường cực kỳ kiềm. Điều này xảy ra vì ion hydroxit (OH⁻) có khả năng hút proton rất mạnh, tạo ra nước trong quá trình đó làm cho sự phân ly trở nên hoàn toàn và không thuận nghịch.
Cụ thể, khi OH⁻ gặp một proton tự do (ví dụ từ một axit), chúng kết hợp thành nước – một phân tử rất bền về mặt năng lượng. Đây là lý do tại sao KOH phản ứng hoàn toàn và nhanh chóng với hầu hết các axit để tạo thành muối và nước.
\[OH^- + H^+ \to H2O \quad K_w = 10^{14}\]
Đây là phản ứng cực kỳ tỏa nhiệt, bù lại năng lượng phân ly ban đầu giải thích vì sao KOH có tính base cực mạnh.
Tính chất hóa học tổng quát
KOH thể hiện đầy đủ tính chất của bazơ mạnh tan hoàn toàn trong nước, với các đặc điểm:
- Tạo dung dịch có pH ~14, ăn mòn protein, là chất hữu cơ có tính ăn da mạnh.
- Phản ứng với acid tạo muối và nước (trung hòa hoàn toàn).
- Phản ứng với oxit acid tạo muối.
- Phản ứng với muối phản ứng trao đổi ion.
- Tham gia các phản ứng thủy phân base của ester, amid,…
- Hút SO₂ từ không khí tạo K₂SO₃ và KHSO₃.
- Là chất khử nước yếu, nhưng là chất thủy phân mạnh.
- Phản ứng oxi hóa – khử đặc biệt trong môi trường kiềm.
Phản ứng đặc trưng và cơ chế điện tử
Phản ứng trung hòa với acid
\[KOH + HCl \to KCl + H_2O\]
Tổng quát:
\[AOH + HX \to AX + H_2O\]
KOH phản ứng với mọi axit mạnh hoặc yếu để tạo thành muối kali và nước. Cơ chế đơn giản: ion OH⁻ nhận proton từ axit, hình thành nước. Phản ứng này xảy ra hoàn toàn, giải phóng nhiều nhiệt và được ứng dụng rộng rãi trong trung hòa hóa học.
Phản ứng với oxit acid (P₂O₅, CO₂, SO₂, Cl₂O,…)
KOH có thể thủy phân các hợp chất như ester và amide, biến chúng thành muối của acid và rượu hoặc amoniac. Cơ chế thường bắt đầu bằng việc OH⁻ tấn công vào nguyên tử carbon của nhóm cacbonyl (C=O), sau đó phân cắt liên kết để tạo sản phẩm. Đây là những phản ứng kiểu axit–bazơ Lewis, nơi OH⁻ là base.
\[2KOH + CO_2 \to K_2CO_3 + H_2O\]
\[KOH + CO_2 \to KHCO_3\]
Phản ứng với muối tạo kết tủa hydroxide kim loại
\[FeCl_3 + 3KOH \to Fe(OH)_3 \downarrow + 3KCl\]
OH⁻ phản ứng với ion kim loại trung tâm → tạo hydroxit không tan. Mức độ kết tủa phụ thuộc vào hằng số Ksp và pH dung dịch.
Phản ứng với hợp chất hữu cơ – thủy phân
- Ester: \[RCOOR’ + KOH \to RCOOK + R’OH\]
- Amide: \[RCONH_2 + KOH \to RCOOK + NH_3\]
Cơ chế: OH⁻ tấn công điện tích δ⁺ trên C=O → mở vòng trung gian tetrahedral → phân cắt tạo sản phẩm. Đây là phản ứng kiểu nucleophilic acyl substitution trong môi trường base.
Phản ứng khử nước yếu
KOH không phải chất hút nước mạnh, nhưng có thể loại nước trong phản ứng tách nước nội phân tử, khi có xúc tác nhiệt:
\[C_2H_5OH \xrightarrow{[KOH,t°]} C_2H_4 + H_2O\]
- Phản ứng đặc biệt – KOH trong môi trường nhiệt cao
- Phản ứng với kim loại amphoteric (Al, Zn)
\[2Al + 2KOH + 6H_2O \to 2K[Al(OH)_4] + 3H2 \uparrow\]
Một số kim loại như nhôm hoặc kẽm có thể phản ứng với KOH trong môi trường nước, sinh ra khí hydro và tạo thành phức chất hydroxo. Ví dụ, nhôm phản ứng với KOH trong nước sẽ tạo ra phức tetrahydroxoaluminate kali và giải phóng khí hydro. Đây là phản ứng oxy hóa – khử điển hình trong môi trường kiềm, với OH⁻ vừa làm base, vừa làm phối tử.
Cơ chế:
- OH⁻ làm môi trường base và phối tử.
- Al bị oxi hóa → ion Al³⁺ → tạo phức bền với OH⁻.
- H₂ sinh ra do mất electron từ kim loại.
Phản ứng với halogen
\[Cl_2 + 2KOH \to KCl + KClO + H2O\]
Ở nhiệt độ thấp, clo có thể phản ứng với dung dịch KOH tạo thành hỗn hợp kali clorua và kali hypoclorit (KCl và KClO), được dùng trong chất tẩy trắng. Ở nhiệt độ cao, sản phẩm thay đổi thành kali clorat (KClO₃), ứng dụng trong chất nổ và pháo hoa.
\[3Cl_2 + 6KOH \to 5KCl + KClO_3 + 3H_2O\]
Tính ăn mòn và ứng dụng công nghiệp
KOH là chất rắn màu trắng, hút ẩm mạnh, dễ tan trong nước, tan nhanh hơn và tạo dung dịch đậm đặc hơn so với NaOH. Do đó, nó thường được dùng khi cần dung dịch kiềm mạnh, nhưng không muốn tăng áp suất thẩm thấu quá nhiều.
Vì có khả năng phân hủy chất hữu cơ, protein và dầu mỡ, KOH được sử dụng nhiều trong công nghiệp làm sạch, xà phòng hóa, sản xuất chất tẩy rửa, dung dịch điện phân trong pin alkaline, xử lý dầu mỏ và xử lý nước thải.
Trong phòng thí nghiệm, KOH thường được dùng như một chất tạo môi trường kiềm, chất hút SO₂ hoặc chất nền cho nhiều phản ứng hữu cơ cần base mạnh nhưng không tạo muối phụ khó kiểm soát.
Phân tích cơ chế hữu cơ của phản ứng giữa CH₃COOH và KOH: Từ phân cực đến đứt gãy liên kết
Phản ứng giữa axit axetic (CH₃COOH) và kali hiđroxit (KOH) được coi là một phản ứng axit–bazơ điển hình trong hóa học vô cơ. Tuy nhiên, ở cấp độ hóa học hữu cơ, quá trình này liên quan đến sự tái phân bố mật độ electron, phân cực liên kết O–H, đứt gãy liên kết cộng hóa trị và hình thành liên kết ion mới. Dưới đây là phân tích chi tiết về cơ chế hữu cơ của phản ứng này.
Cấu trúc phân tử và phân cực nội tại trong CH₃COOH
Phân tử axit axetic có công thức cấu tạo là CH₃–C(=O)–OH. Trong đó, nhóm chức carboxylic –COOH là trung tâm phản ứng chính, gồm hai phần chính: nhóm cacbonyl (C=O) và nhóm hydroxyl (–OH) gắn với cùng nguyên tử cacbon.
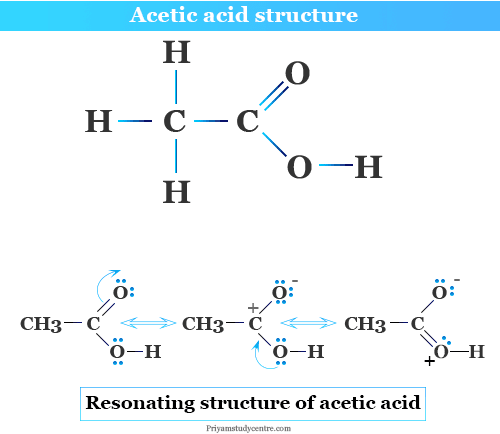
Liên kết C=O là một liên kết đôi phân cực mạnh. Oxi mang điện âm cao kéo mật độ electron về phía nó, khiến nguyên tử cacbon mang điện tích dương một phần (δ⁺), trong khi oxi mang điện tích âm một phần (δ⁻). Sự phân cực này không chỉ ảnh hưởng đến nhóm C=O mà còn cảm ứng đến liên kết O–H kế cận, làm cho proton (H⁺) của nhóm –OH trở nên dễ bị tấn công hoặc tách ra hơn.
Hiệu ứng cảm ứng của nhóm C=O làm tăng độ axit của nhóm –OH so với các ancol thông thường. Điều này giải thích tại sao CH₃COOH là một axit yếu nhưng mạnh hơn rất nhiều so với CH₃OH hay C₂H₅OH.
Cơ chế phản ứng với KOH: Tấn công nucleophile và đứt gãy liên kết O–H
Trong môi trường dung dịch, KOH phân ly hoàn toàn thành ion K⁺ và OH⁻. Ion OH⁻ là một bazơ mạnh và cũng là một nucleophile mạnh với mật độ điện tích âm tập trung ở nguyên tử oxi. Tại thời điểm phản ứng, OH⁻ tiếp cận phân tử CH₃COOH.
Tương tác diễn ra như sau:
OH⁻ tấn công vào proton (H⁺) của nhóm hydroxyl –OH trên CH₃COOH. Phản ứng này không phải là kiểu tấn công nucleophile vào nguyên tử cacbon mà là tác nhân base tách proton ra khỏi nhóm OH, giống như một quá trình khử proton (deprotonation).
Khi OH⁻ tiếp cận, cặp electron trong liên kết O–H trên CH₃COOH dịch chuyển hoàn toàn về phía oxi, làm đứt liên kết O–H và giải phóng một proton H⁺. Điều này được thúc đẩy bởi khả năng tạo thành phân tử nước – một sản phẩm bền vững.
Kết quả, ta thu được ion CH₃COO⁻ (axetat), trong đó cặp electron không liên kết trên nguyên tử oxi nay được delocalize qua cộng hưởng với nhóm C=O, làm cho cấu trúc này bền vững hơn.
Ổn định ion axetat sau phản ứng
Ion axetat CH₃COO⁻ có hai cấu trúc cộng hưởng và liên tục chuyển đổi qua lại:
- Oxi bên phải giữ cặp electron âm, còn liên kết đôi ở C=O.
- Oxi bên trái giữ liên kết đôi, còn oxi bên phải giữ cặp electron âm.
Sự cộng hưởng này khiến cả hai nguyên tử oxi đều mang tính âm như nhau, làm phân tử ổn định về mặt điện tử. Nhờ cộng hưởng, mật độ âm được phân bố đều giữa hai nguyên tử oxi, giúp giảm năng lượng toàn hệ và làm cho quá trình khử proton thuận lợi hơn.
Cation K⁺ từ KOH liên kết với một trong hai nguyên tử oxi mang điện âm của CH₃COO⁻ bằng liên kết ion tĩnh điện, tạo thành muối CH₃COOK tan tốt trong nước.
So sánh với các phản ứng khác: Tại sao OH⁻ không tấn công vào nhóm C=O?
Ion OH⁻ về lý thuyết có thể đóng vai trò là nucleophile để tấn công vào C=O, như trong phản ứng cộng nucleophile với aldehyde hoặc cetone. Tuy nhiên, trong trường hợp axit cacboxylic, C=O không dễ bị OH⁻ tấn công vì:
- cặp liên kế C=O bị giảm hoạt tính bởi sự liên hợp với nhóm OH liền kề.
- Môi trường nước và điều kiện phản ứng không thúc đẩy phản ứng cộng.
Thay vào đó, OH⁻ dễ dàng lấy proton của nhóm OH – vốn là mục tiêu dễ tiếp cận hơn về mặt điện tử.
Vai trò của hiệu ứng cảm ứng và liên hợp
Sự dễ tách proton từ nhóm OH trong CH₃COOH là hệ quả của hai yếu tố:
- Hiệu ứng cảm ứng âm từ nhóm C=O kéo mật độ electron về phía nguyên tử oxi của nhóm cacbonyl, làm nhóm OH bị phân cực mạnh.
- Hiệu ứng liên hợp π–π giúp phân bố lại electron khi mất proton, làm cho ion axetat ổn định qua cộng hưởng.
Cả hai hiệu ứng này làm tăng tính axit của phân tử và khiến phản ứng trung hòa với OH⁻ xảy ra dễ dàng và hoàn toàn.
Phản ứng ngược và tính thuận nghịch
Phản ứng giữa CH₃COOH và KOH là phản ứng thuận, xảy ra gần như hoàn toàn vì sản phẩm tạo ra là H₂O – một phân tử rất bền và có năng lượng thấp. Tuy nhiên, nếu phản ứng xảy ra trong dung môi không phân cực, hoặc nếu nồng độ OH⁻ thấp, thì cân bằng có thể bị dịch chuyển ngược.
\[CH_3COOH \leftrightarrow CH_3COO^- + H^+ \quad K_a = 1,8 \times 10^{-5}\]
\[H_2O \leftrightarrow H^+ + OH^- \quad K_w = 10^{-14}\]
Dù vậy, trong thực tế, với dung dịch nước và bazơ mạnh như KOH, quá trình đứt gãy liên kết O–H là hoàn toàn và không thuận nghịch ở điều kiện thường.
Ứng dụng trong thực tiễn và nghiên cứu
Phản ứng trung hòa KOH và CH₃COOH có nhiều ứng dụng:
- Trong phân tích định lượng: dùng để xác định nồng độ axit yếu thông qua chuẩn độ bằng KOH.
- Trong tổng hợp muối hữu cơ: tạo ra CH₃COOK để sử dụng trong công nghiệp dược, thực phẩm, hóa mỹ phẩm.
- Trong nghiên cứu động học phản ứng axit – bazơ: giúp khảo sát mức độ phân ly của axit yếu, xác định hằng số cân bằng Ka.
- Trong xử lý môi trường: trung hòa dung dịch axit dư trong xử lý nước thải hoặc kiểm soát pH hệ sinh thái nhân tạo.
Bài tập vận dụng
Bài toán 1: Cho 50 ml dung dịch CH₃COOH 0.1M, thêm vào dung dịch KOH 0.1M. Hỏi cần bao nhiêu ml KOH để trung hòa hết axit? Viết phương trình phản ứng và xác định pH sau phản ứng.
Giải:
Phương trình hóa học:
\[CH_3COOH + KOH \to CH_3COOK + H_2O\]
Tính thể tích KOH cần thiết để trung hòa CH₃COOH:
\[n_{CH_3COOH} = 0,1 \times 0,05 = 0,005 (mol)\]
Tỉ lệ phản ứng giữa KOH và CH₃COOH = 1:1, ta có:
\[n_{KOH} = n_{CH_3COOH} = 0,005 (mol)\]
\[V_{KOH} = n/C = \frac{0,005}{0,1} = 0,05 (L) = 50 (ml)\]
Tính pH của dung dịch:
Dung dịch sau khi trung hòa chứa các ion CH₃COO⁻, K⁺ và H₂O.
Ta có các phương trình:
\[CH_3COOH \leftrightarrow CH_3COO^- + H^+ \quad K_{a1} = 1,8 \times 10^{-5}\]
\[H_2O \leftrightarrow OH^- + H^+ \quad K_{a2} = 10^{-14}\]
Đảo ngược phương trình phân ly CH₃COOH, ta có:
\[CH_3COO^- + H^+ \leftrightarrow CH_3COOH \quad K_{a3} = \frac{1}{K_{a1}} \frac{1}{1,8 \times 10^{-5}}\]
Gộp phương trình đảo với phương trình phân ly nước, ta có:
\[CH_3COO^- + H_2O \leftrightarrow CH_3COOH + OH^- \quad K_a = K_{a2} \times K_{a3} = \frac{10^{-14}}{1,8 \times 10^{-5}} = 5,6 \times 10^{-10}\]
gọi nồng độ CH₃COOH là a, ta có:
\[{[CH_3COO^-]} = 0,1 – a\]
\[{[CH_3COOH]} = a\]
\[{[H_2O]} = a\]
\[\frac{[CH_3COOH][OH^-]}{[CH_3COO^-]} = \frac{a^2}{0,1 – a} = 5,6 \times 10^{-10}\]
\[\Rightarrow [OH^-] = 7,21 \times 10^{-6}\]
\[pH = 14 + log[OH^-] = 14 + log(10^{-6}) = 14 – 5,14 = 8,86\]
