Phản ứng giữa natri sunfit và axit sunfuric là phản ứng đặc trưng của muối sunfit khi tác dụng với axit mạnh. Khi cho natri sunfit tiếp xúc với axit sunfuric, phản ứng xảy ra mạnh mẽ, tạo ra muối sunfat, khí sunfurơ và nước. Khí sunfurơ là sản phẩm khí duy nhất thoát ra trong phản ứng này và có thể nhận biết dễ dàng qua mùi hăng sốc đặc trưng. Phản ứng thể hiện tính khử của ion SO₃²⁻ khi gặp môi trường axit đặc có tính oxi hóa và là minh chứng điển hình cho phản ứng giải phóng khí từ muối axit khi gặp axit mạnh hơn.

Phương trình hóa học
\[Na_2SO_3 + H_2SO_4 \to Na_2SO_4 + SO_2 \uparrow + H_2O\]
Phương trình tự cân bằng.
Điều kiện phản ứng
Phản ứng xảy ra ở nhiệt độ phòng hoặc khi đun nhẹ, không cần xúc tác hay điều kiện khó khăn.
Tuy nhiên, cần đảm bảo rằng dụng dịch H₂SO₄ có nồng độ vừa đủ để có thể cung cấp ion H⁺ cho quá trình axit hóa sunfit. Nên sử dụng dung dịch H₂SO₄ trong khoảng 1 M đến 3 M. Môi trường cần được thoáng khí hoặc trong tủ hút khí do khí SO₂ độc.
Nguyên lý phản ứng
Phản ứng trên là sự kết hợp của hai hiện tượng: phản ứng trao đổi ion và phản ứng phân hủy axit yếu. Cụ thể, phản ứng diễn ra qua hai giai đoạn:
Giai đoạn 1 là quá trình trao đổi ion giữa muối sunfit và axit mạnh:
\[Na_2SO_3 + H_2SO_4 \to Na_2SO_4 + H_2SO_3\]
Trong đó, axit sunfuric đặc thay thế ion natri bằng ion H⁺ để tạo ra axit sunfurơ.
Giai đoạn 2 là sự phân hủy của axit sunfurơ:
\[H_2SO_3 \to SO_2 + H_2O\]
Quá trình phân hủy này xảy ra gần như tức thời do H₂SO₃ là axit không bền, có khuynh hướng phân hủy ngay khi hình thành.
Tổng hợp lại, phản ứng là sự chuyển hóa ion SO₃²⁻ thành khí SO₂ nhờ sự cung cấp H⁺ mạnh từ axit sunfuric. Vai trò trung gian của H₂SO₃ chỉ là lý thuyết vì thực tế nó không tồn tại bền vững trong dung dịch.
Cách thực hiện phản ứng
Chuẩn bị hóa chất và dụng cụ:
- Natri sunfit (Na₂SO₃): dạng bột khô hoặc dung dịch bão hòa
- Dung dịch Axit sunfuric (H₂SO₄ loãng)
- Ống nghiệm chịu nhiệt hoặc cốc thủy tinh có dung tích từ 100 mL trở lên
- Hệ thống dẫn khí nếu thu khí SO₂: gồm ống dẫn, ống nghiệm hoặc dụng cụ hấp thụ khí
- Dung dịch hồ tinh bột và KI để nhận biết khí SO₂
- Dung dịch KMnO₄ loãng để phản ứng với khí SO₂ (nếu cần chứng minh tính khử)
Tiến hành:
Cho một lượng nhỏ Na₂SO₃ vào đáy ống nghiệm hoặc cốc. Dùng ống nhỏ giọt thêm từ từ dung dịch H₂SO₄ vào, tránh nhỏ giọt nhanh để phản ứng không diễn ra quá mạnh. Ngay sau khi H₂SO₄ tiếp xúc với Na₂SO₃, phản ứng diễn ra sinh khí. Khí SO₂ bốc lên có thể được dẫn vào dung dịch nhận biết hoặc thu riêng nếu cần xác định khối lượng hoặc thể tích.
Lưu ý:
- Luôn đeo găng tay, kính bảo hộ, và làm việc trong tủ hút khí để tránh tiếp xúc với SO₂ độc hại
- Không sử dụng lượng lớn axit trong thời gian ngắn, tránh tỏa nhiệt quá mức làm nứt dụng cụ thủy tinh
- Không dùng bình đậy kín vì SO₂ sinh ra làm tăng áp suất nội trong hệ phản ứng
Nhận biết phản ứng
Quá trình nhận biết phản ứng có thể dựa vào ba yếu tố chính: khí sinh ra, đặc điểm vật lý, và phản ứng hóa học chứng minh.
Trước hết, khí SO₂ sinh ra có mùi hăng, cay, rất dễ nhận biết bằng cảm giác. Mùi này gây kích ứng hô hấp ngay cả ở nồng độ thấp.
Thứ hai, có hiện tượng sủi bọt khí khi thêm axit vào muối. Điều này cho thấy có phản ứng sinh khí đang xảy ra.
Thứ ba, khí SO₂ có thể được nhận biết thông qua các phản ứng đặc trưng như:
- Làm mất màu dung dịch KMnO₄ tím do phản ứng khử: \[5SO_2 + 2MnO_4^- + 2H_2O \to 5SO_4^{2-} + 2Mn^{2+} + 4H^+\]
- Phản ứng với dung dịch KI/hồ tinh bột: SO₂ oxi hóa I⁻ thành I₂, tạo phức xanh lam
\[SO_2 + 4I^- + 4H^+ \to 2I_2 + S \downarrow +H_2O\]
\[I_2 + I^- \to [I_3]^- \]
Các hiện tượng trên đều xác nhận rõ ràng phản ứng đang xảy ra và sản phẩm khí SO₂ đã được sinh ra.
Tính chất hóa học của Lưu huỳnh Dioxit (SO₂) – Nâng cao
Cấu trúc phân tử và đặc điểm điện tử
Lưu huỳnh dioxit (SO₂) là một phân tử gồm một nguyên tử lưu huỳnh (S) liên kết với hai nguyên tử oxy (O), tồn tại ở trạng thái khí dưới điều kiện thường. Phân tử SO₂ có cấu trúc hình chữ V (góc), chứ không phải là đường thẳng. Góc liên kết O–S–O xấp xỉ 119 độ, điều này phản ánh trạng thái lai hóa sp² của nguyên tử lưu huỳnh, tương tự như trong các phân tử có cấu trúc tam giác phẳng như SO₃.

Điều đặc biệt nằm ở sự tồn tại của một cặp electron chưa sử dụng trên lưu huỳnh, tạo ra sự đẩy lùi tương tác giữa các orbital liên kết, dẫn đến sự lệch góc và làm cho SO₂ trở thành một phân tử phân cực mạnh. Ngoài ra, trong mỗi liên kết giữa lưu huỳnh và oxy đều có tính chất cộng hưởng: liên kết giữa S và O dao động giữa liên kết đơn và liên kết đôi thông qua cộng hưởng điện tử. Điều này giúp phân tử SO₂ có tính ổn định tương đối cao dù là chất khí, nhưng cũng khiến các liên kết S–O linh hoạt và dễ tham gia phản ứng hóa học.
Bản chất hóa học: Oxit axit – lưỡng tính oxy hóa–khử
Về bản chất hóa học, SO₂ là một oxit axit điển hình của lưu huỳnh ở trạng thái oxi hóa +4. Điều này có hai hệ quả rất quan trọng: thứ nhất, nó dễ dàng phản ứng với nước để tạo axit; thứ hai, nó là một chất khử mạnh, có thể dễ dàng bị oxi hóa lên mức oxi hóa +6 (SO₃ hoặc H₂SO₄). Trong một số điều kiện đặc biệt, SO₂ còn thể hiện tính oxy hóa nhẹ, nhưng yếu hơn nhiều so với tính khử.
Do đó, SO₂ là một ví dụ điển hình của chất lưỡng tính oxy hóa–khử trong hóa học vô cơ – có thể vừa nhận vừa cho electron tùy vào bản chất chất phản ứng đối diện.
Phản ứng oxy hóa – khử: Tính khử là đặc trưng nổi bật
Lưu huỳnh trong SO₂ mang mức oxi hóa +4 – thấp hơn mức +6 (trong SO₃, H₂SO₄), nên SO₂ có xu hướng bị oxy hóa, đặc biệt trong môi trường acid hoặc có mặt chất oxy hóa mạnh.
Ví dụ, SO₂ phản ứng với kali pemanganat (KMnO₄) trong môi trường acid:
\[5SO_2 + 2KMnO_4 + 2H_2O \to 2MnSO_4 + K_2SO_4 + 2H_2SO_4\]
Trong phản ứng này, SO₂ bị oxy hóa thành H₂SO₄ (lưu huỳnh tăng số oxi hóa từ +4 lên +6), còn Mn⁷⁺ bị khử thành Mn²⁺. Phản ứng này thường được dùng trong chuẩn độ hoặc nhận biết SO₂ trong hóa phân tích.
Một ví dụ khác là phản ứng với brom trong nước:
\[SO_2 + Br_2 + 2H_2O \to 2HBr + H_2SO_4\]
SO₂ cũng bị oxy hóa, còn Br₂ bị khử thành HBr.
Phản ứng oxy hóa: Hình thành SO₃
Trong điều kiện có xúc tác như V₂O₅ và nhiệt độ cao (450°C), SO₂ có thể bị oxy hóa bởi O₂ tạo thành SO₃ – tiền chất quan trọng để sản xuất axit sunfuric:
\[2SO_2 + O_2 \leftrightarrow 2SO_3\]
Đây là phản ứng thuận nghịch, tỏa nhiệt, có cơ chế xúc tác bề mặt, và là bước quan trọng trong quy trình công nghiệp sản xuất H₂SO₄.
Phản ứng với hợp chất halogen oxi hóa mạnh
Ví dụ điển hình là Cl₂, Br₂ trong dung dịch kiềm:
\[SO_2 + Cl_2 + 2H_2O \to 2HCl + H_2SO_4\]
Ở đây, SO₂ bị oxi hóa thành H₂SO₄ (S từ +4 → +6), còn Cl₂ bị khử thành HCl. Đây là phản ứng hiếm gặp hơn so với phản ứng với Br₂ hoặc KMnO₄, nhưng giúp cho thấy SO₂ có khả năng phản ứng với các phi kim oxi hóa mạnh, nhất là khi có mặt nước.
Phản ứng với khí H₂S – phản ứng “tự khử–tự oxi hóa”
Một trong những phản ứng đặc trưng, điển hình trong vô cơ:
\[SO_2 + 2H_2S \to 3S \downarrow + 2H_2O\]
Đây là một phản ứng disproportionation (phản ứng phân huỷ không đối xứng), trong đó:
- SO₂ (S⁴⁺) bị khử thành S⁰: \[S^{4+} + 4e \to S^0\]
- H₂S (S⁻²) bị oxi hóa thành S⁰: \[S^{2-} \to S^0 + 2e\]
Cả hai chất đều chuyển về lưu huỳnh nguyên tố.
Phản ứng này được ứng dụng trong:
- Phản ứng định tính SO₂ hoặc H₂S,
- Sản xuất lưu huỳnh nguyên chất trong xử lý khí thải công nghiệp.
Phản ứng với muối nitrat hoặc nitrit
SO₂ có thể khử nitrat hoặc nitrit trong môi trường acid:
\[3SO_2 + 2HNO_3 + 2H_2O \to 3H_2SO_4 + 2NO \uparrow\]
Hay:
\[SO_2 + 2HNO_2 \to H_2SO_4 + 2NO \uparrow\]
Hoặc:
\[SO_2 + 2NaNO_3 + 2HCl \to H_2SO_4 + 2NO_2 \uparrow + 2NaCl\]
Các phản ứng này xảy ra trong hệ có nitrat/nitrit và cho thấy khả năng khử mạnh của SO₂ trong môi trường acid.
Phản ứng với oxit kim loại chuyển tiếp – tạo muối hỗn hợp
Ví dụ, SO₂ phản ứng với MnO₂ ở nhiệt độ cao có thể tạo mangan sunfit hoặc manganat tùy điều kiện:
\[MnO_2 + SO_2 \to MnSO_4\]
Phản ứng này không phổ biến trong phòng thí nghiệm nhưng có thể xảy ra trong điều kiện khử khắc nghiệt.
Phản ứng tạo phức và tính chất phi truyền thống
Một tính chất ít được chú ý của SO₂ là khả năng đóng vai trò phối tử trong các phức kim loại. Do cặp electron chưa sử dụng trên nguyên tử lưu huỳnh, SO₂ có thể liên kết với kim loại chuyển tiếp như Pt, Ru… thông qua liên kết dative, tạo nên các phức chất có tính chất đặc biệt, dùng trong xúc tác hoặc hóa học vật liệu.
Ngoài ra, SO₂ còn có thể phản ứng với một số hợp chất hữu cơ không bền, tham gia phản ứng cộng vào nối đôi C=C hoặc phản ứng với amin để tạo hợp chất sulfonamid.
Ứng dụng thực tiễn
SO₂ là một trong những khí vô cơ được sử dụng rộng rãi trong cả công nghiệp và phòng thí nghiệm. Nó là nguyên liệu chính trong sản xuất axit sunfuric – hóa chất công nghiệp quan trọng bậc nhất. Ngoài ra, SO₂ được dùng làm chất tẩy trắng giấy và vải, chất khử trùng, chất bảo quản thực phẩm (nhất là nho khô, hoa quả sấy), và chất khử trong các phản ứng hóa học.
Tác động môi trường và sinh học
SO₂ là khí độc, đặc biệt gây hại cho hệ hô hấp ở nồng độ cao. Nó là một trong những nguyên nhân chính gây ra mưa axit – khi SO₂ bị oxy hóa thành SO₃ rồi hòa tan vào nước mưa tạo thành H₂SO₄. Do đó, việc xử lý SO₂ trong khí thải công nghiệp (như từ nhà máy nhiệt điện đốt than, luyện kim) là vấn đề then chốt trong kiểm soát ô nhiễm không khí.
\[2SO_2 + O_2 + 2H_2O \xrightarrow{điện tích} 2H_2SO_4\]
Vì sao axit sunfurơ (H₂SO₃) có tính kém bền
Cấu trúc phân tử của H₂SO₃ và cơ sở liên kết
Axit sunfurơ (H₂SO₃) thường được biểu diễn với cấu trúc gồm nguyên tử lưu huỳnh trung tâm, liên kết với ba nguyên tử oxy: một liên kết đôi S=O và hai nhóm hydroxyl –OH. Cấu trúc có thể viết như sau:
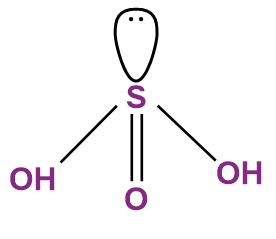
Tuy nhiên, nghiên cứu lý thuyết hóa học lượng tử và thực nghiệm cho thấy H₂SO₃ không thể cô lập ở trạng thái rắn hay khí. Trong thực tế, nó chỉ tồn tại thoáng qua trong dung dịch SO₂ tan trong nước và rất dễ phân hủy. Điều này phản ánh tính kém bền nội tại của H₂SO₃ do các yếu tố về liên kết và năng lượng, cụ thể:
Lưu huỳnh trong H₂SO₃ ở trạng thái oxi hóa +4, không ổn định bằng +6 (trong H₂SO₄).
Hai nhóm –OH tạo ra mật độ điện tích âm cao quanh S làm liên kết bị phân cực mạnh, lực đẩy giữa các cặp electron không liên kết (lone pairs) gây ra sự căng thẳng trong cấu trúc.
Không có hệ liên hợp bền vững hoặc cộng hưởng hiệu quả để phân tán mật độ electron như trong H₂SO₄.
Giải thích tính kém bền của H₂SO₃ theo nhiệt động học và động học
1. Yếu tố nhiệt động học:
H₂SO₃ có xu hướng tự phân hủy thành SO₂ và H₂O vì điều này tạo ra hai phân tử sản phẩm có năng lượng liên kết tổng thấp hơn:
Phản ứng phân hủy:
\[H_2SO_{3 (aq)} \leftrightarrow SO_2 \uparrow + H_2O\]
Về mặt nhiệt động học:
SO₂ và H₂O đều là những phân tử bền vững hơn H₂SO₃ về cấu trúc và năng lượng liên kết.
Nhiệt phân hủy của H₂SO₃ là một phản ứng tỏa nhiệt nhẹ với ΔG° âm, cho thấy phản ứng tự phát trong điều kiện thường.
Đồng thời, sản phẩm khí SO₂ có xu hướng thoát ra khỏi hệ, khiến phản ứng dịch chuyển thuận theo nguyên lý chuyển dịch cân bằng Le Châtelier nếu hệ hở.
2. Yếu tố động học:
Ngoài yếu tố bền – không bền về năng lượng, cần xét đến cơ chế phân tử và đường phản ứng:
Cấu trúc H₂SO₃ có hai nhóm –OH gắn vào cùng một nguyên tử S, làm xuất hiện khả năng tái sắp xếp electron dễ dàng.
Trong dung dịch, các nhóm –OH có thể trao đổi proton, tạo ra một trung gian HSO₃⁻ hoặc phân tử trung tính không bền, rồi sau đó loại nước.
Sự hình thành liên kết đôi S=O thứ hai từ một nhóm –OH (thông qua loại nước) tạo thành phân tử SO₂ là quá trình thuận lợi về mặt động học, vì liên kết đôi S=O có năng lượng cao và bền.
Ngoài ra, khi H₂SO₃ phân hủy tạo khí SO₂, entropy tăng đáng kể (do tạo thêm một phân tử khí từ chất tan trong nước), điều này càng thúc đẩy phản ứng phân hủy xảy ra nhanh hơn.
So sánh với H₂SO₄: Vì sao H₂SO₄ bền còn H₂SO₃ kém bền?
Cả H₂SO₃ và H₂SO₄ đều có hai nhóm hydroxyl –OH, nhưng có sự khác biệt lớn về cấu trúc và độ bền:
1. Về số oxi hóa và cộng hưởng:
Trong H₂SO₄, lưu huỳnh có số oxi hóa +6 và cấu trúc cộng hưởng mạnh với 4 nguyên tử oxy, bao gồm hai liên kết đôi S=O. Sự phân bố điện tích và khả năng delocalize electron khiến H₂SO₄ cực kỳ ổn định.
Trong H₂SO₃, lưu huỳnh chỉ ở mức +4, không đủ điều kiện để tạo cộng hưởng toàn phần. Cấu trúc chỉ có một liên kết đôi S=O, còn lại là hai nhóm –OH làm phân tử mất cân bằng điện tử và khó ổn định.
2. Về khả năng loại nước:
Trong H₂SO₃, việc mất một phân tử nước có thể tạo ra SO₂ có cấu trúc bền vững với hai liên kết đôi S=O cộng hưởng.
Trong H₂SO₄, việc mất nước không sinh ra chất mới bền hơn mà còn phá vỡ hệ liên kết π đã ổn định ⇒ không có lợi về mặt nhiệt động học hay động học.
Kết luận: mặc dù số lượng nhóm –OH giống nhau, nhưng do cấu trúc cộng hưởng, điện tích phân bố và khả năng tái tổ chức khác nhau, H₂SO₄ hoàn toàn bền vững trong khi H₂SO₃ rất dễ phân hủy.
Mở rộng so sánh với axit carbonic (H₂CO₃)
Tương tự H₂SO₃, H₂CO₃ cũng rất kém bền và dễ phân hủy thành H₂O và CO₂. Giải thích gồm:
Nhiệt động học: H₂O và CO₂ bền hơn H₂CO₃.
Động học: Cấu trúc C(OH)₂ dễ tái tổ chức thành C=O, với cơ chế loại nước nội phân tử nhanh.
Entropy: Sự hình thành CO₂ khí giúp tăng entropy mạnh ⇒ càng thúc đẩy phản ứng phân hủy.
Điểm đặc biệt là trong môi trường kín (như chai nước ngọt có gas), CO₂ được giữ lại dưới áp suất cao, nên cân bằng chuyển dịch ngược, giúp duy trì H₂CO₃ trong dung dịch. Khi mở nắp, CO₂ thoát ra, cân bằng chuyển dịch theo chiều thuận, H₂CO₃ tiếp tục phân hủy.
Ứng dụng của phản ứng và sản phẩm
Phản ứng được sử dụng phổ biến trong phòng thí nghiệm để tạo khí SO₂ nhằm phục vụ cho các mục đích nhận biết, khử chất oxi hóa, hoặc làm thuốc thử phân tích.
Khí SO₂ là sản phẩm trung tâm của phản ứng và có ứng dụng rộng rãi trong công nghiệp:
- Là chất tẩy màu trong ngành giấy, dệt và thực phẩm (với nồng độ kiểm soát nghiêm ngặt).
- Là tác nhân khử trong các phản ứng hóa học, đặc biệt trong phân tích định lượng các chất oxi hóa mạnh.
- Là chất trung gian trong sản xuất axit sunfuric theo quy trình tiếp xúc (Contact Process), sau khi bị oxi hóa thành SO₃.
- Dùng trong công nghiệp xử lý nước và khử trùng.
Tuy nhiên, SO₂ cũng là khí độc và là nguyên nhân chính gây ra mưa axit, do đó phải kiểm soát chặt chẽ việc phát thải khí này trong công nghiệp.
Bài tập vận dụng
Đề bài: Cho 200 ml dung dịch Na₂SO₃ 0.2 mol/L phản ứng vừa đủ với dung dịch H₂SO₄ loãng.
a) Tính thể tích khí SO₂ thu được ở điều kiện tiêu chuẩn.
b) Dẫn khí SO₂ vào dung dịch thuốc tím KMnO₄. Viết phương trình phản ứng và tính khối lượng thuốc tím sử dụng.
c) Thêm BaCl₂ vào dung dịch đã phản ứng tạo kết tủa trắng, tính khối lượng kết tủa.
Giải:
a) Tính thể tích khí SO₂:
Phương trình hóa học:
\[Na_2SO_3 + H_2SO_4 \to Na_2SO_4 + SO_2 \uparrow + H_2O\]
\[n_{Na_2SO_3} = 0,2 \times 0,2 = 0,04 (mol)\]
\[n_{SO_2} = n_{Na_2SO_3} = 0,04 (mol)\]
\[V_{SO_2} = 22,4 \times 0,04 = 0,896 (L) = 896 (ml)\]
b) Tính khối lượng thuốc tím đã sử dụng:
Phương trình hóa học:
\[5SO_2 + 2KMnO_4 + 2H_2O \to 2MnSO_4 + K_2SO_4 + 2H_2SO_4\]
\[n_{KMnO_4} = \frac{2}{5} n_{SO_2} = \frac{2}{5} \times 0,04 = 0,016 (mol)\]
\[m_{KMnO_4} = 0,016 \times 158 = 2,528 (gram)\]
c) Tính khối lượng kết tủa:
Áp dụng định luật bảo toàn nguyên tố ta có:
\[n_{SO_4^{2-}} = n_{SO_2} = 0,04 (mol)\]
Phương trình hóa học:
\[Ba^{2+} + SO_4^{2-} \to BaSO_4 \downarrow\]
\[n_{BaSO_4} = n_{SO_4^{2-}} = 0,04 (mol)\]
\[m_{BaSO_4} = 0,04 \times 233 = 9,32 (gram)\]
