CuO + H2SO4 là phương trình phản ứng giữa đồng (II) oxit và axit sunfuric là một phản ứng hóa học thuộc dạng oxit bazơ tác dụng với dung dịch axit tạo thành muối mới và nước. Đây cũng còn được gọi là một phản ứng trung hòa thường gặp trong chương trình hóa học lớp 8 hoặc lớp 9. Hãy cũng theo dõi bài viết để nắm rõ hơn về phương trình phản ứng và các dạng bài tập hóa học liên quan nhé các em.
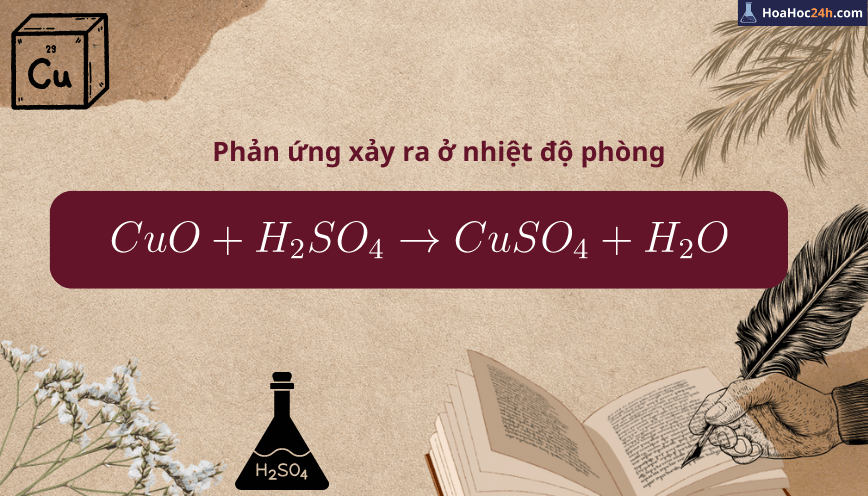
Phương trình hóa học CuO + H2SO4
CuO + H2SO4 → CuSO4 + H2O
Chất tham gia
– CuO là một oxit bazơ.
– H2SO4 là một axit mạnh.
Chất sản phẩm
– CuSO4 là một muối.
– H2O là nước.
Phân loại phản ứng
→ Phản ứng trao đổi
Trong phản ứng hóa học trên, chúng ta không thấy có sự thay đổi hóa trị hay nói cách khác là không có sự thay đổi số oxi hóa của các chất. Do vậy, phản ứng trên là phản ứng trao đổi bình thường. CuO + H2SO4 không phải là phản ứng oxi hóa – khử như nhiều bạn đang tìm kiếm thông tin trên mạng.
Thay đổi điều kiện của phản ứng
Trong phản ứng hóa học trên, việc thay đổi điều kiện cũng không có quá nhiều. Đơn giản có thể thấy CuO là không thể thay đổi được rồi và chúng ta chỉ còn có thể thay đổi h2so4 thành axit đặc hoặc các điều kiện khác như H2SO4 đặc nguội, H2SO4 đặc nóng dư thì cũng đều cho một kết quả giống nhau đó chính là tạo thành muối đồng (II) sunfat và nước. Để lí giải điều này, chúng ta hãy quan sát vào hóa trị của đồng trong hợp chất Cuo.
Trong hợp chất CuO, đồng đang có hóa trị là II hay số oxi hóa cao nhất của đồng là +2 rồi nên khi tác dụng với những chất oxi hóa mạnh thì ion đồng cũng không còn khả năng thay đổi hóa trị hoặc số oxi hóa nữa. Do vậy, cuối cùng chúng ta sẽ thu được một sản phẩm như nhau ở những điều kiện phản ứng khác nhau.
Phương trình phản ứng hóa học của CuO với H2SO4 ở nhiều điều kiện khác nhau
CuO + H2SO4 → CuSO4 + H2O
Phản ứng trên xảy ra với điều kiện h2so4 là một axit loãng, như vậy cuo có tác dụng với h2so4 loãng.
CuO + H2SO4(l) → CuSO4 + H2O
Phản ứng trên xảy ra với điều kiện h2so4 là một axit đặc.
CuO + H2SO4(đặc, nóng) → CuSO4 + H2O
Phản ứng trên xảy ra với điều kiện H2SO4 và được đun nóng. Một câu hỏi cũng được rất nhiều bạn tìm kiếm đó chính là CuO+H2SO4 đặc nóng ra SO2 ?
Câu trả lời ở đây là CuO+H2SO4 đặc nóng không thể tạo ra được SO2 các em nhé vì như thầy đã phân tích ở trên. Đây không phải là phản ứng oxi hóa – khử do vậy sẽ không tạo thành SO2 được.
CuO + H2SO4(đặc, nguội) → CuSO4 + H2O
CuO + H2SO4 có phải phản ứng oxi hóa khử?
Trong nhiều dạng bài tập hóa học chúng ta đều biết đến CuO là một oxit đồng (II) có được thi thực hiện phản ứng khác là cho Cu tác dụng với Oxi ở nhiệt độ cao. Trong chương trình hóa học lớp 8 chúng ta áp dụng quy tắc hóa trị sẽ xác định được hóa trị của đồng là II bằng với hóa trị của oxi là II và sau này chúng ta học lên cao sẽ thấy rằng trong hợp chất trên đồng đang có số oxi hóa là +2 cao nhất rồi nên đồng trong hợp chất CuO sẽ không còn số oxi hóa nào để thực hiện phản ứng nữa.
Từ những dữ liệu trên chúng ta kết luận được ngay phản ứng trên khi thực hiện sẽ không phải là phản ứng oxi hóa – khử.
Vậy những hợp chất nào của đồng có thể thực hiện được với H2SO4 đặc nóng phản ứng oxi hóa – khử ?
Trong một phản ứng oxi hóa khử điều nhận biết trước tiên nhất chính là có sự thay đổi số oxi hóa của đơn chất hoặc các chất trong hợp chất nên những hợp chất nào của đồng mà đồng có số oxi hóa khác +2 thì khi tác dụng được với H2SO4 đặc nóng khả năng cao là một phản ứng oxi hóa khử.
Ví dụ:
Cu + H2SO4 đặc nóng →CuSO4 + SO2 + H2O
Cu2O + H2SO4đặc nóng →CuSO4 + SO2 + H2O
Như vậy, CuO + H2SO4 đặc nóng ra SO2 là phản ứng không thể tạo được khí SO2 do Cu trong CuO đã đạt số oxi hóa cao nhất là +2 nên không thể cho Electron được nữa.
Bài tập vận dụng
Từ phương trình phản ứng hóa học trên chúng ta thấy rất nhiều dạng bài tập liên quan và được mở rộng vô cùng phong phú. Một trong những dạng bài tập hóa học cơ sở đó chính là tính theo phương trình hóa học.
Câu 1. Cho 8 gam CuO tác dụng hoàn toàn với dung dịch axit sunfuric vừa đủ. Sau phản ứng thu được m gam muối. Viết phương trình phản ứng hóa học và tính m.
Lời giải
– Số mol của CuO là 0,1 mol.
CuO + H2SO4 → CuSO4 + H2O
0,1 0,1
Vậy khối lượng muối tạo thành sau phản ứng là 0,1. 64 + 32 + 64) = 16 gam.
Như vậy, ở những phương trình phản ứng và một vài ví dụ bài tập trên các em đã nắm được những thông tin rất cần thiết về một phương trình phản ứng hóa học vô cơ rồi. Tuy nhiên, trên thực tế còn có nhiều điều kiện khác nhau nữa để phương trình có thể xảy ra do vậy thầy rất cần sự đóng góp ý kiến từ các em qua bình luận ở bên dưới để bài viết thêm phong phú và hoàn thiện hơn. Xin cảm ơn quý độc giả, các em học sinh đã đồng hành xây dựng ngân hàng phương trình phản ứng hóa học.

Với đam mê truyền đạt và chia sẻ những kiến thức hóa học hữu ích với mọi người, TC Chemistry không chỉ giới hạn việc chia sẻ kiến thức hóa học từ cơ bản đến nâng cao, mà còn cung cấp câu hỏi, đề thi thử và phương trình phản ứng hóa học để giúp người đọc hiểu sâu về chủ đề và phát triển kỹ năng trong lĩnh vực này.